소아 뇌종양의 종류
수모세포종 (Medulloblastoma) 15~20% 차지, 어른에서도 약 20% 발생, 주로 소뇌에,
소뇌 성상세포종 (Cerebellar astrocytoma) 10~20% 차지,
상의세포종 (Ependymoma) 약 10% 차지, 주로 뇌실 내에서 발생,
뇌간신경교종 (Brain stem glioma) 10~20% 차지,
시신경교종 (Optic nerve glioma)
두개인두종 (Craniopharyngioma)
배세포종 (Germ cell tumor)
원시신경외배엽종양 (Primitive neuroectodermal tumor)
맥락총 유두종 ( Choroid plexus papilloma)
악성 맥락총 종양 ( Choroid plexus carcinoma)
유피낭종 (Dermoid cyst)
지주막 낭종 (Arachnoid cyst)
성인 뇌종양의 종류
신경교종 ( Glioma )
3가지 타입의 교세포에서 종양이 생길 수 있다. 성상세포종, 희돌기교세포종, 상의세포종. 시신경세포종이나 뇌간 신경교종 같은 이름은 종양이 생긴 위치에서 따온 이름으로 특별히 세포조직이 다른 것은 아님.
희돌기세포교종 ( Oligodendroglioma )
희돌기세포에서 발생한 교종. 저등급(low-grade(grade II) 또는 고등급 (grade III 또는 이형성). 대뇌 반구에 위치. 이중 절반가량이 전두엽에 위치. 간질발작은 가장 흔한 증상으로 특히 저등급 종양에서 두드러진다.
교모세포종 ( Glioblastoma )
교모세포종은 원발성 뇌종양의 약 20%를 차지하며 신경교종의 50%를 차지. 성인에 더 흔하고 여성보다 남성에 더 흔함. 매우 빠른 성장속도. 첫 증상은 뇌압증가로 인한 것이 많은데 두통, 간질, 기억소실, 성격변화가 가장 흔한 증상들.
교질낭종 ( Colloid cyst )
제 3뇌실에 가장 호발하는 양성 교질 낭종. 항상 어른에게서 발생. 전형적으로 3뇌실과 맥락총 천정에 붙어있어 대개 먼로공을 통한 뇌척수액의 흐름을 막아버리기에 뇌수두증과 뇌압항진을 초래. 두통이 가장 흔한 증상.
유표피종 ( Epidermoid cyst )
유피낭종과 유사하며 대개 양성이며 중년의 어른에게서 호발합니다.
혈관모세포종 ( Hemangioblastoma )
혈관모세포종은 양성, 성장속도가 느림, 혈관에 있는 세포에서 기원한 낭성 종양. 주위 정상조직과 잘 구분 되며 침윤도 드물다. 대부분 뇌의 밑부분 즉 후두와의 소뇌나 뇌간에서 흔히 발견. 모든 원발성 뇌종양의 2%를 차지.
림프종 ( Lymphoma )
대부분의 중추신경계의 림프종은 B형 세포에서 기인한 림프종. 전체 원발성 뇌종양의 0.5~2% 차지. 대뇌 반구에서 대부분 발생. 가장 흔한 증상은 성격이나 생활 패턴이 바뀌고 혼돈, 뇌압상승 증세가 나타날 수 있다.
수막종 ( Meningioma )
거미막(수막의 한 겹)에서 발생한 것으로 전체 원발성 뇌종양의 27%를 차지. 중년 여성에서 호발. 대부분의 수막종은 양성이며 I 등급이고, 천천히 자라는 종양으로 대개 침윤도 없다. 대개 대뇌 반구와 두개저, 그리고 후두개에 잘 생기며 이 종양의 위험인자는 이전에 두부가 방사선에 노출이 된 경우와 유전질환인 ‘신경섬유증 타입 2 (NFⅡ)’ 를 들 수 있다.
두통, 편운동 마비, 간질, 인성변화 등. 비정형성 뇌수막종 (II등급)은 중간범위의 행태를 보이는데 완전히 악성도 아니면서 뇌조직에 침윤하여 들어가고 재발을 잘하며 빠른 성장을 보임. 이형성 또는 악성 뇌수막종의 경우, 전체 뇌수막종의 5%를 차지하며 주위조직으로 침투해 들어가는 경향이 있다.
전이성 뇌종양 ( Metastatic brain tumor )
전이된 것. 뇌쪽으로 전이가 잘 되는 암은 폐암, 유방암, 멜라닌 색소종 같은 악성 피부암, 신장암, 대장암 정도
신경 교종 치료를 위한 약물 재배치 : 현재 상태 및 미래 관점
신경 교종은 가장 흔한 원발성 뇌종양입니다.
그중 교모세포종 (GBM)은 가장 악성 표현형을 가지고 있습니다.
GBM의 현재 치료법은 최대 수술적 절제술과 보조 화학 방사선 요법입니다.
화학 요법의 1 차 치료제는 이미다조 테트라지논 유도체인 테모졸로미드 (TMZ)입니다 [ 4 ].
3상 임상에서 방사선 요법과 병용 및 보조 TMZ가 원발성 GBM 환자의 치료에 효과적이라는 것이 밝혀졌습니다 [ 5 ]. 알킬화 항암제인 테모졸로미드 사용, 현재의 표준 요법에도 불구하고 대부분의 GBM 환자는 2 년 이내에 사망합니다.
임상 시험을 통해 암 환자에서 혈관내피 성장인자 (VEGF)에 대한 재조합 인간화 단일 클론 항체인 베바시주맙 (BEV)의 치료 효과가 밝혀졌습니다 [ 7 ].
새로 진단된 GBM 환자에서 BEV의 치료 효과를 조사하기 위해 대규모 임상 연구가 수행되었습니다 [ 8 , 9 ].
그러나 신경 교종 환자에서 BEV의 임상적 이점은 아직 알려져 있지 않습니다.
GBM의 예후를 개선하기 위해 새로운 화학 요법제가 시급히 필요합니다.
그 중 하나인 기존 약물의 적응증을 넓히는 약물 재배치가 주목을 받고있다.
여기에서는 악성 신경 교종 치료제로 새롭게 확인된 약제 후보 물질을 이러한 원래의 식별을 바탕으로 10 가지 분류로 분류한다. 일부 약물은 희망을 가지고 임상 시험 중입니다.
또한 GBM의 응용 프로그램으로 약물 재배치를 달성하기 위해 극복해야 할 장애물과 향후 전망에 대해 논의했습니다.
1.1 메트포르민
메트포르민은 미토콘드리아 복합체 I의 산화적 인산화 억제를 통해 AMP 활성화 단백질 키나아제 (AMPK)를 활성화하여 AMP / ATP 비율을 증가시켜 포유류의 라파마이신 표적 (mTOR)을 억제하고 세포 사멸을 촉진합니다 [ 11 , 12 ].
메트포르민 매개 AMPK 활성화에 이어 포크 헤드 박스 O3 (FOXO3) 활성화는 GSC 분화를 유도하고 종양 원성을 감소시킵니다 [ 13].
Cancer Genome Atlas는 isocitrate dehydrogenase (IDH) 유전자 1과 2에서 미스 센스 돌연변이를 보고했습니다.
돌연변이 IDH 단백질에 의해 생성된 암 대사 산물인 D-2-Hydroxyglutarate (D-2HG)는 암의 발달과 진행에 기여합니다. 글루타민의 α- 케토글루타레이트 (αKG) 로의 전환은 글루타메이트 탈수소 효소 (GDH)에 의해 촉매되며, 메트포르민에 의한 GDH의 억제는 IDH 1/2 돌연변이를 갖는 신경아 교종에서 D-2HG의 생성을 감소시킵니다 [ 14 ].
염화물 세포 내 채널 1 (CLIC1)은 GBM을 포함한 다양한 암의 진행에 관여합니다 [ 15 , 16 , 17 ].
CLIC1은 G1 /S 전환의 조절에 관여하며 메트포르민은 CLIC1의 선택적 억제에 의해 GSC에서 G1 세포주기 정지를 유발합니다.[18 ].
Clinical Practice Research Datalink를 사용한 역학 연구에서는 메트포민의 사용이 신경 교종 위험 감소와 관련이 없다고보고했습니다 [ 19 ].
대규모 무작위 대조 시험에서 1731 명의 환자를 대상으로 한 통합 분석에서 메트포르민 사용은 새로 진단된 GBM 환자의 OS 또는 무 진행 생존 (PFS)과 유의한 관련이 없었습니다 [ 20 ].
기존의 후향적 및 역학 연구 결과가 다소 실망 스럽지만 무작위 임상 시험이 진행 중이며 향후 긍정적인 결과를 기대합니다.
2.1 안지오텐신 II (AT2) 수용체 차단제
AT2는 레닌-안지오텐신-알도스테론 시스템에서 중요한 역할을 하며 주로 안지오텐신 I 수용체 (AT1R) 및 AT2 수용체의 활성화를 통해 혈관 항상성을 조절합니다.
최근 연구에 따르면 AT2는 세포 증식, 분화, 아폽토시스 및 이동에 역할을 합니다.
또한, AT2는 VEGF와 같은 성장 인자의 자극을 통해 혈관 신생을 유도하는데, 이는 AT2가 암 치료의 표적임을 시사합니다 [ 21 , 22 ].
Rivera et al. 처음으로 신경 교종 세포에서 AT1R의 존재를 보고 하고 C6 신경 교종 쥐에서 losartan으로 AT1R의 선택적 차단이 종양 성장 및 혈관 신생의 억제를 통해 항 종양 효과를 발휘한다는 것을 입증했습니다 [ 22].
이 그룹은 또한 losartan을 사용한 치료가 VEGF의 억제를 통해 종양 성장을 억제하고 in vitro 및 in vivo에서 세포 사멸을 촉진한다는 것을 보여주었습니다 [ 23 ].
새로 진단된 GBM 환자 81 명을 대상으로 한 후향적 분석에 따르면 AT2R 차단제 또는 안지오텐신 전환 효소 (ACE) 억제제를 현재 치료와 함께 투여하면 뇌 부종 및 스테로이드 요구량이 감소하고 임상 결과가 개선되는 것으로 나타났습니다 [ 24 ].
그럼에도 불구하고 GBM 환자를위한 현재 치료법에 losartan을 포함시킨 무작위 위약 대조 시험인 ASTER 시험 (NCT01805453)은 스테로이드 요구량의 차이나 OS 중앙값의 유의한 증가를 보여주지 않았습니다 [ 25 ].
2.2 β- 차단제
Tewarie et al. β- 차단제가 교종에 미치는 영향에 대한 이전의 전임상 및 임상 연구를 요약했으며, cAMP 수준 감소, 시간 의존적 세포주기 정지 및 세포 이동 감소를 통해 세포 증식 감소에 주목했습니다 [ 26 ].
그러나 재발성 GBM 환자 218 명을 대상으로 한 후향적 코호트 연구에서 Johansen et al. β- 차단제 사용과 OS 및 PFS 사이의 상관 관계는 관찰되지 않았습니다 [ 27 ].
2.3 칼슘 채널 차단제
특정 Ca 2+ 채널 및 펌프의 변화된 발현 및 활성이 악성 신경 교종에서 보고되었습니다 [ 28 ].
일반적으로 사용되는 항 고혈압 약물인 Amlodipine은 저장 운영 칼슘 진입 (SOCE, Store-operated calcium entry)의 활성화에 의해 종양 악성에 관여하는 하마 경로를 통한 YAP / TAZ 신호 전달을 억제하여 종양 성장을 억제하는 것으로 나타났습니다 .
이것은 세포 내 Ca 2+ 유입을 허용한다 [ 29 ].
GBM의 칼슘 신호 전달에 대한 대부분의 연구는 최근에 이루어졌으며 추가 연구가 필요합니다.
3 항간질제
GBM의 일반적인 증상은 모든 경우의 절반에서 발생하는 간질입니다.
따라서 환자는 종종 발프로산 (VPA) 및 레비티라세탐 (LEV)과 같은 항 간질약으로 치료됩니다 .
유전자 발현을 조절하는 히스톤 단백질의 효소적 변형이 치료 약물 표적으로 조사되었습니다.
히스톤은 히스톤 아세틸 트랜스퍼라제 (HAT)와 히스톤 데아세틸라제 (HDAC)에 의해 변형됩니다.
HDAC 억제제 (HDACi)는 HAT에 의한 아세틸화를 강화하고 과 아세틸화 상태를 유발하여 세포 분화, 아폽토시스, 세포주기 정지, 화학 요법에 대한 민감성, 이동 및 혈관 신생 억제와 같은 여러 항 종양 효과를 발휘합니다 [ 30 ].
3.1 발프로산(VPA)
최근 VPA는 효과적인 HDACi로 밝혀졌으며 암 치료제로 제안되었습니다 [ 31 ].
VPA는 신경 교종 세포의 증식을 억제하고 시험관 내 및 생체 내 과다 아세틸화를 증가시켜 방사선 감수성을 향상시킵니다 [ 32 ].
VPA의 또 다른 항 종양 효과는 Akt / ERK의 활성화를 통한 GSK3β의 억제에 의한 세포 자멸사의 유도입니다 [ 33 ].
여러 연구에 따르면 GSK3β의 억제는 생존과 증식을 억제하고 인간 GBM 세포에서 세포 사멸을 유도합니다 [ 34 ].
그러나 일부 메타 분석에서는 GBM 환자에서 VPA 병용 치료의 임상적 이점이 금기인 것으로 나타났습니다 [ 35 , 36 , 37 ,38 , 39 ] 및 추가 연구가 필요합니다.
3.2 레베라세탐(LEV)
LEV는 HDAC1 전사를 증가시키고 MGMT 프로모터에서 mSin3A / HDAC1 코어프레서 복합체를 동원하며 p53을 MGMT 프로모터에 직접 결합하여 MGMT 발현을 억제하는 것으로 나타났습니다 [ 40 ].
따라서 LEV는 신경 교종 세포 증식을 억제하고 신경 교종 세포와 GSC에서 TMZ의 세포 독성 효과를 크게 강화합니다 [ 40 , 41 ]. 2상 임상 시험 (NCT02815410)이 진행 중이며 향후 결과가 예상됩니다.
MGMT : O6-methylguanine-DNA methyltransferase
GSC : glioma stem-like cell
4.1 클로로퀸 (CHQ)
CHQ는 말라리아 치료제입니다 [ 42 ].
이 약제는 신경 교종 세포를 포함한 일부 암세포에 항 종양 효과가 있습니다 [ 43 ].
그러나 신경 교종에서 CHQ의 항 종양 효과의 메커니즘은 잘 알려져 있지 않다.
일부 연구에서는 CHQ가 자가 포식을 조절하여 암세포 사멸을 초래한다고 제안했으며 [ 44 ], 최근 연구에서는 CHQ 치료의 더 많은 효과가 밝혀졌습니다.
CHQ는 아미노산의 신진 대사를 조절하고 당 생성을 억제합니다 [ 42 ].
CHQ 투여는 또한 신경 교종 세포에서 미토콘드리아 막 전위의 변화를 유도하고 세포 사멸을 유발합니다 [ 45].
일부 연구에서는 CHQ 치료와 관련된 분자 신호 전달을 조사했습니다.
CHQ에 의해 유발되는 신경 교종 세포의 분자 신호 변화는 종양 형성에 역할을 하는 형질전환 성장인자 -β (TGF-β) 및 핵 인자-카파 B (NF-κB)의 신호 전달 경로의 억제를 포함합니다 [ 42 , 45 ] .
CHQ 치료는 또한 매트릭스 메탈로프로테이나제 -2 (MMP-2)의 억제에 의해 신경 교종 세포 침입을 억제하고 G2 / M 단계에서 신경 교종 세포의 축적에 의해 방사선 민감성을 개선합니다 [ 45 ].
이러한 in vitro 연구 결과를 바탕으로 신경 교종 환자에서 CHQ의 치료 효과를 조사한 임상 시험이 수행되었습니다 [ 43]. 원발성 GBM 환자에 대한 무작위 시험 (이중 맹검, 위약 대조)에서 CHQ 치료군과 위약군 사이에 통계적으로 유의한 차이가 없었습니다.
그러나 CHQ 그룹의 사망률은 위약 그룹의 절반 정도였습니다 [ 46 ].
추가 임상 시험이 진행 중입니다 (NCT03243461, NCT02432417 및 NCT02378532).
4.2 펜타미딘
Pentamidine은 Pneumocystis jirovecii로 인한 폐렴 치료에 효과적입니다 .
이 약물은 포도당 대사, 단백질 합성, 아미노산 수송, 리보핵산 (RNA) 합성의 억제를 통해 치료 효과를 발휘합니다 [ 47 ]. 이전 연구는 다양한 암에서 펜타미딘의 치료 효과를 보여주었습니다 [ 48 ].
한 시험관 내 연구에 따르면 펜타미딘은 간 재생의 포스파타제 (PRL) 억제를 통해 암 활성을 억제했으며 PRL 포스파타제 억제는 Akt 및 ERK의 활성화를 억제했습니다.[ 48 ], [ 49].
이러한 연구를 바탕으로 신경 교종 세포와 GSC에서 펜타 미딘의 효과를 조사했습니다.
Pentamidine은 신경 교종 세포와 GSC의 증식을 억제하고 GSC의 줄기를 감소 시켰습니다.
또한 현재의 화학 방사선 요법은 때때로 림프구 감소증을 부작용으로 유도하고 환자는 P. jirovecii로 인한 폐렴을 앓을 수 있기 때문에 악성 신경 교종 치료제로 펜타미딘을 용도 변경하는 것은 임상적 이점이 있습니다 .
펜타미딘의 분자 메커니즘을 조사하기 위한 추가 연구가 진행 중입니다.
미래에는 악성 신경 교종 환자에 대한 펜타미딘의 이점을 결정하기 위한 임상 시험이 보장됩니다.
5 항 정신병 약물
5.1 플루복사민
플루복사민은 1986 년부터 항우울제로 사용되어 왔으며 선택적 세로토닌 재 흡수 억제제 활성으로 인해 불안 장애 치료에 널리 사용되어 뇌의 세로토닌 수준을 충분히 유지하여 기능을 발휘합니다 [ 50 , 51 ].
fluvoxamine으로 처리된 신경 교종 세포의 분자 신호 변화는 액틴 중합 조절제, 초점 부착 키나제 및 mTOR 복합체 2의 활성을 억제함으로써 달성됩니다 [ 55 , 56 ].
두개 내 이종 이식 마우스 모델에 fluvoxamine을 매일 투여하면 생존이 크게 연장되고 종양 세포가 생체 내에서 정상 뇌 조직으로 침투하는 것을 차단합니다 [ 57 ].
따라서 fluvoxamine은 초점 접착 및 액틴 해중합을 방해하고 GBM 세포의 이동 및 침입 능력을 차단하며 환자의 생존을 연장합니다.
Fluvoxamine은 신경 교종 치료에 잠재적으로 효과적인 항 침습 약물입니다.
5.2 플루스피릴린
diphenylbutylpiperidine 계열 약물 중 하나인 Fluspirilene은 효과적이고 전통적이며 오래 지속되는 항 정신병약입니다 [ 58 , 59 ].
Fluspirilene은 효과적인 Ca 2+ 채널 차단 활성을 나타내며 [ 60 ] 시냅스 전달을 억제합니다.
따라서 fluspirilene은 발작을 완화시킬 수 있습니다 [ 58 ].
그러나 최근 연구에 따르면 간세포 암 [ 61 ] 및 GBM [ 62 ]과 같은 일부 난치성 암에 대한 플루스피릴린의 새로운 효과가 나타났습니다.
시험관 내 조사에 따르면 플루스피릴린은 세포 생존력, 줄기, 구 형성 능력 및 GSC의 증식을 약화시킬뿐만 아니라 신호 변환기 및 전사 활성 인자 3 (STAT3) 활성의 억제를 통해 GBM 세포의 침입을 억제합니다. GBM 세포의 핵 감소 [ 62 ].
In vivo에서 fluspirilene은 종양 부피를 현저히 감소시키고 두개 내 이종 이식 마우스 모델에서 생존을 연장시킵니다 [ 62 ].
이러한 결과는 fluspirilene이 잠재적인 새로운 항 신경 교종 후보임을 시사합니다.
6 항 종양 제
6.1 에리불린
미세소관의 비 탁산 억제제인 Eribulin 은 2010 년 FDA에서 4 기 유방암 치료용으로 승인 되었습니다. [63] , [64],[65 ].
Eribulin은 세포 유사분열 동안 미세소관 활동의 억제를 통해 종양 세포의 성장을 방지하고 M기 정지를 유도하여 세포 사멸을 초래합니다 [ 66 , 67 ].
다양한 암에 대한 이러한 영향을 기반으로 최근 연구에 따르면 에리불린이 에리불린 유도 M기 정지를 통해 종양을 방사선에 민감하게 만들고 방사선 단독보다 더 많은 DNA 손상을 유발한다는 사실이 입증되었습니다.
이는 절단된 카스파제 -3 및 절단된 폴리 -ADP 리보스 중합 효소 수준의 증가를 유도하고 유사 분열 재앙을 초래합니다 [ 69 , 70 ].
에리불린과 함께 방사선을 투여하는 것에 대한 생체 내 연구는 이 조합이 두개 내 이종 이식 GBM 마우스 모델의 생존을 연장한다는 것을 보여 주었다 [ 71 ].
Eribulin은 또한 혈관 재 형성을 억제하고 이종 이식 마우스 모델에서 방사선에 의한 비정상 혈관 미세 환경을 정상화합니다 [ 71].
에리불린은 약물 스크리닝을 통해 TERT-RdRP의 특정 억제제로 확인되었습니다.[ 76 ].
따라서 TERT 표적화 요법은 신경 교종을 치료하는 새로운 방향이 될 것입니다.
신경 교종을 치료하기 위해 에리불린을 사용한 시험관 내 및 생체 내 실험 모두 에리불린이 항암 활성을 발휘하고 미세관 억제제 활성에 더해 TERT-RdRP 억제제로서의 기능을 통해 신경 교종 증식을 억제한다는 것을 보여주었습니다.
현재 eribulin은 재발성 GBM (UMIN ID : 000030359)에서 의사가 주도하는 2상 임상 시험을 진행 중입니다.
유방암과 지방 육종 치료에 사용되는 항암제. 완전히 합성인 거대 고리 케톤 아날로그 해양의 천연물 halichondrin의 B
미국에서 Halaven 약물 출원 N201532와 관련된 5 개의 활성 특허가 있습니다.
첫 번째는 2019 년 6 월 16 일에 만료되고 마지막 (USRE46965)은 2027 년 1 월 8 일에 만료됩니다. [34]
TERT : 텔로머라제 역전사 효소
RdRP : RNA 의존성 RNA 중합 효소
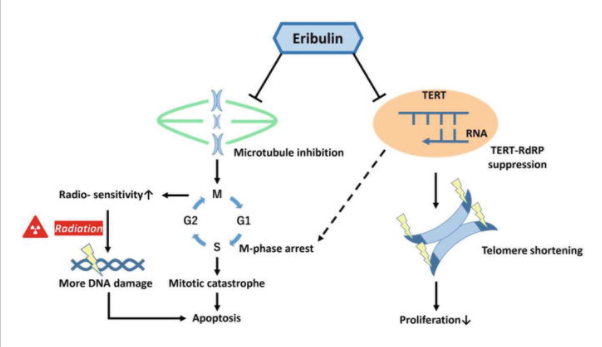
그림 3. 에리불린의 항 종양 메커니즘. 다형성 교모세포종에 대한 에리불린의 효과.
Eribulin은 미세소관 활동을 억제하고 M 단계 정지를 유도하여 세포를 더 방사능에 민감하게 만들고 세포 사멸로 끝납니다. Eribulin은 또한 TERT-RdRP 활성을 억제하여 증식을 억제합니다.
7 항염증제
7.1 아세틸 살리실산 (ASA)
ASA는 프로스타글란딘 E2 (PGE2)를 포함하는 프로스타글란딘의 억제, 아세틸화를 통한 합성 및 시클로옥시게나제 억제를 통해 항암 작용을 합니다 [ 77 , 78 ].
ASA 처리는 성상 세포의 주요 갭 접합 단백질인 connexin 43 (Cx43)의 발현 활성화를 통해 신경 교종 세포의 침입을 억제합니다.
Cx43은 일반적으로 PGE2에 의해 억제됩니다.
따라서 ASA 처리된 신경아 교종 세포는 Cx43을 과발현하고 침입이 억제됩니다 [ 79].
다른 연구에서는 ASA가 신경 교종 진행에 중요한 역할을 하는 Wnt / β-catenin / T-cell factor (TCF) 신호 전달 경로를 억제한다는 사실이 밝혀졌습니다 [ 79 ].
Wnt / β-catenin / TCF 경로 억제는 다운 스트림 유전자, c-myc 및 cyclin D1 의 조절을 통해 신경 교종을 억제 합니다.
ASA는 음파 고슴도치 (SHH) / 교종 관련 종양 유전자 동족체 1 (GLI1) 경로를 억제하고 상피에서 중간엽으로의 전이를 조정합니다 [ 80 ].
SHH / GLI1 경로는 TMZ에 의한 손상 회복과도 관련이 있습니다 [80].
이러한 연구를 기반으로 악성 신경 교종 환자에서 ASA의 치료 효과를 조사하기 위해 후향적 코호트 연구가 수행되었습니다. 결과는 ASA의 사용이 WHO 등급 III 신경 교종 환자에서 더 높은 OS 및 PFS와 관련이 있음을 보여주었습니다.
그러나 WHO 등급 IV 신경 교종 환자의 OS와 PFS에는 차이가 없었다 [ 81 ].
미래에는 악성 신경 교종에서 ASA의 효과를 결정하기 위해 전향적 다기관 무작위 연구가 보장됩니다.
OS : overall survival ,전반적인 생존
PFS : progression-free survival , 무진행 생존
7.2 설파살라진 (SAS)
류마티스 관절염 및 염증성 장 질환 치료제로 승인된 SAS는 악성 신경 교종 치료제로 사용될 수 있다 [ 82 ].
SAS는 일반적으로 시스틴 흡수, 글루타메이트 방출, 활성 산소종 (ROS)의 증가를 유발하는 NF-κB 및 Xc-항 포터 시스템의 활성화를 차단하여 항 염증 효과를 발휘합니다 . [83 ].
NF-κB는 GBM 조직에서 활성화되고 세포 증식과 생존을 촉진합니다.
SAS는 세포주기를 차단하고 시험관 내에서 세포 사멸을 유도하며 마우스 이종 이식 모델에서 뇌종양의 성장을 억제합니다 [ 83 , 84].
그러나 재발성 악성 신경 교종 환자를 대상으로 한 현재의 SAS 요법에 대한 I / II 상 연구에서는 SAS의 임상적 이점이 없었습니다 [ 85 ].
최근에 새로 GBM 진단을 받은 환자를 대상으로 현재 SAS 치료법에 대한 I / II 상 연구를 수행한 바 [ 86 ], 현재 SAS 치료군에 비해 OS 및 PFS가 증가하지 않는 것으로 나타났습니다.
결과는이 새로운 요법이 발작 조절을 향상시킬 것이라고 제안합니다. 그러나 SAS의 치료 효과는 제한적입니다.
8 다중 약물 병용 요법
8.1 CLOVA 칵테일
시메티딘, 리튬, 올란자핀 및 발프로에이트로 구성된 CLOVA 칵테일은 GBM에서 조절이 어려운 GSK3β를 표적으로 합니다 [ 87 , 88 , 89 ].
GSK3β 억제의 치료 효과는 종양 세포 생존 및 증식 억제, 테모졸라미드 (TMZ) 및 방사선 조사와의 시너지, 침입 약화, 다양한 경로를 통한 GSC (glioma stem-like cell) 분화 유도입니다 [ 90].
Olanzapine은 AMPK 이화 작용을 자극하고 p53 의존적 자가 포식을 유도합니다.
HDACi로서 VPA는 방사선 효과를 향상시킵니다.
TMZ 내성 재발 GBM 환자를 대상으로 CLOVA 칵테일의 효능과 안전성을 조사하기위한 I / II 상 임상 연구에서는 이 요법이 잘 견디며 TMZ만 투여한 대조군보다 OS가 더 높은 것으로 나타났습니다 [ 87 ].
GSK3β : 글르코겐 합성 효소 키나제 3 베타
8.2 CUSP9 * 처리
CUSP9 *라고 하는 9가지 용도 변경 약물 [aprepitant, artesunate, auranofin, captopril, celecoxib, disulfiram (DSF), itraconazole, ritonavir 및 sertraline]은 종양 세포의 치료 저항성을 예방하기 위해 개발되었습니다.
CUSP9 *는 매일 저용량 TMZ와 함께 9가지 약물을 동시에 투여함으로써 종양 세포가 TMZ 의 세포 독성 효과에 취약하도록 다양한 보완 중복 경로를 표적으로 합니다 . [ 91 ]
각 약물은 그림 5에 표시된 17 개의 분자와 경로에 대해 서로 다른 억제 효과를 나타냅니다 .
Auranofin과 DSF는 세포 내 활성 산소종의 수준을 증가시킵니다 [ 96].
최근 TMZ를 사용한 실험적인 CUSP9 * 전략은 Wnt / β-catenin 경로의 차단을 통해 GSC의 줄기와 종양 형성을 억제하는 것으로 나타났습니다 [ 92 ].

그림 5.
temozolomide를 사용한 다중 약물 치료에 의한 다중 분자 표적 요법.
기존의 여러 약물 조합, CLOVA 칵테일, CUSP9 * 치료 및 FTT 칵테일은 GBM 악성 표현형을 나타내는 여러 신호 경로를 표적으로합니다.
약어 : 5-LO, 5- 리폭시게나제 ; ABCG2, ATP- 결합 카세트 수퍼 패밀리 G 구성원 2; ACE, 안지오텐신 전환 효소; ALDH, 알데히드 탈수소 효소; AMPK, 아데노신 모노 포스페이트; CA, 탄산탈수효소; CDK, 사이클린 의존성 키나아제; COX, 사이클로 옥시게나제; FAK, 초점 접착 키나아제; GSK3β, 글리코겐 신타제 키나제 -3β; HDAC, 히스톤 데 아세틸라제; HH, 고슴도치; JNK, c-Jun N- 말단 키나제; MGMT, O6- 메틸 구아닌 -DNA 메틸 트랜스퍼라제; MMP, 매트릭스 메탈로프로테이나제; MT, 멤브레인 유형; mTOR, 라파 마이신의 포유류 표적; NK-1, 뉴로키닌-1; NF-κB, 핵 인자 -kappaB; P-gp, P- 당 단백질; ROCK, rho-연관 단백질 키나제; ROS, 활성 산소종; TCTP, 번역 제어된 종양 단백질; TF, 조직 인자; TGF-β, 형질 전환 성장 인자 -β; TMZ, 테모졸로미드; VEGF, 혈관 내피 성장 인자.
8.3 FTT 칵테일
암세포를 정상 체세포로 재 프로그래밍하고 역전시키는 독특한 치료법이 주목을 끌었습니다.
fasudil, tranilast 및 TMZ의 조합은 GBM 세포를 뉴런 유사 세포로 재 프로그래밍하는 것으로 확인되었습니다 [ 93 ].
FTT 칵테일로 처리된 GBM 세포는 정상적인 뉴런 형태, 유전자 발현 및 전기 생리학적 특성을 나타내며 처리되지 않은 세포보다 악성 종양이 낮습니다.
이것은 세 가지 약물 의 시너지 효과 때문일 수 있습니다 . [ 93 ]
또한, FTT 칵테일은 TMZ 단독보다 GBM 이종 이식 모델에서 종양 성장을 억제하고 생존을 연장합니다.
Fasudil은 TMZ 내성 신경 교종 세포주에서 ROCK2 / 모에신 / β- 카테닌 경로를 억제하고 ATP 결합 카세트 수퍼 패밀리 G 멤버 2 수송체를 하향 조절하여 TMZ에 대한 민감성을 증가시킵니다.[94 ].
mTOR 억제에 의한 ROCK의 억제는 ROCK 단독의 억제보다 더 효과적으로 in vitro 및 in vivo에서 뉴런 리 프로그래밍을 수행하며, 이는 더 많은 약물 조합의 가능성을 시사합니다
mTOR의 억제와 ROCK의 억제는 단독 ROCK 억제 [보다 시험관 내 및 생체 내에서보다 효율적으로 신경 세포의 리프로그래밍을 발휘 95 이상의 약품의 조합의 가능성을 시사한다].
Tranilast 단독은 TGF-β 제한을 통해 신경 교종 진행을 억제합니다 [ 96 ].
FTT 칵테일의 종양 억제 기능의 기본 메커니즘이 완전히 밝혀지지는 않았지만 이 칵테일은 악성 신경 교종에 대한 현재 치료법을 개선할 수 있습니다.
9 기타 약물
9.1 디설피람(DSF)
알코올 남용 치료를 위한 FDA 승인 약물인 디설피람은 GBM의 치료제가 될 수 있습니다.
DSF는 암 줄기 세포의 기능적 마커인 알데히드 탈수소 효소의 비가역적 억제제입니다 . [ 97 ], [ 98 ]
체외 연구에서 DSF가 MGMT의 억제제이고 알킬화기 유발 종양 사멸의 효능을 향상시키는 것으로 밝혀졌습니다 [ 99 ]. 또 다른 연구에서는 DSF가 세포 진행과 세포질 분열을 조절하는 폴로 유사 키나제 -1의 억제를 통해 GSC의 성장과 자가 재생을 억제한다는 사실이 밝혀졌습니다 [ 97 ].
DSF의 활동은 구리에 의해 강화되고 GSC 죽음을 유도합니다 [ 100].
그러나 재발성 TMZ 내성 GBM 환자를 대상으로 TMZ + DSF에 대한 개방 라벨 단일군 2상 연구에서는 객관적 반응률이 0 %이고 DSF 병용 요법이 GBM 환자에 대해 제한된 치료 효과만을 가짐을 보여주었습니다 [ 101 ].
MGMT : O6-methylguanine-DNA methyltransferase
GSC : glioma stem-like cell
9.2 스타틴
이상 지질혈증 치료제인 스타틴은 3- 하이드록시 -3- 메틸글루타릴-코엔자임 A 환원 효소를 억제합니다.
일부 스타틴은 신경 교종 세포에 치료 효과가 있습니다 [ 102 , 103 ].
in vitro에서 simvastatin은 전사인자 -2와 c-Jun을 인산화하여 C6 신경 교종 세포의 세포 사멸을 유도한다 [ 102 ]. Lovastatin은 ERK의 활성화 억제를 통해 신경 교종 세포주의 증식과 이동을 억제합니다 [ 103 ].
후향적 코호트 연구에서는 장기적인 사전 진단 스타틴 섭취가 GBM 환자의 OS를 증가 시킨다고 제안했습니다 [ 104 ]. 또 다른 후향적 코호트 연구는 스타틴 섭취가 GBM 환자의 발작 감소와 관련이 있음을 시사했습니다 [ 105].
그러나 다른 코호트 연구에서는 악성 신경 교종과 스타틴 섭취 사이의 생존 관계를 나타내지 않았습니다.
마지막으로, 이러한 후향적 코호트 연구에 대한 메타 분석 결과 스타틴이 GBM 환자에서 PFS와 OS를 증가시키지 않는다는 것이 밝혀졌습니다 [ 106 ].
미래에는 악성 신경 교종에서 스타틴의 효과를 결정하기 위해 전향적 다기관 무작위 연구가 보장됩니다.
10 전 약제 pre-drugs
10.1 Kenpaullone
GSK3의 강력한 비 선택적 억제제인 Kenpaullone [ 107 ]은 세포주기 조절, 증식, 분화 및 세포 사멸과 관련된 수많은 신호 전달 경로를 조절하는 세린 / 트레오닌 키나아제입니다 [ 108 , 109 ].
Kenpaullone 치료는 신경아 교종 세포 증식을 억제하고, 미토콘드리아에서 항-세포 자멸사 메커니즘을 억제하고, 프로-생존 인자를 억제하고, GSK3β의 하향 조절된 활성을 통해 GSC의 줄기와 생존력을 약화시킵니다 [ 88 , 110 , 111 ].
TMZ와 저용량 kenpaullone의 결합은 C-Myc 매개 아폽토시스의 유도를 통하여 신경교종에 대한 세포독성을 향상 [110].
이러한 결과는 kenpaullone이 신경 교종 치료를위한 잠재적인 화합물임을 시사합니다.
10.2 2-플루오로 팔미트산 (2-FPA)
최근에는 새로운 지방산 억제제 화합물인 2-FPA가 기존의 약물 라이브러리를 사용하여 암 줄기 세포를 표적으로 하는 약물에 대한 약물 스크리닝 시스템을 통해 잠재적인 항 신경 교종 치료제로 확인되었습니다 [ 62 ].
활성 화합물로서 정상 뇌 세포에 대한 2-FPA의 안전성은 아직 밝혀지지 않았습니다.
다른 암에서 2-FPA의 효과를 언급한보고는 없습니다.
GSC와 GBM 세포를 사용한 시험관 내 조사 [ 112 ]는 2-FPA가 GSC의 생존력과 구체 형성 능력을 억제한다는 것을 보여주었습니다.
신경 교종의 증식과 침입에 필수적인 ERK의 탈 인산화를 통해 GBM 세포의 증식을 억제합니다 [ 113];
그리고 세포 침입에 중요한 역할을 하는 MMP-2의 활성 억제를 통해 GBM 세포의 침입을 차단합니다 [ 114 ].
신경 교종에 대한 단일 활성외에도 2-FPA와 TMZ의 조합은 TMZ 내성의 주된 주요 원인인 MGMT의 하향 조절 및 MGMT 프로모터 메틸화의 증가를 통해 시험관 내 신경 교종에 대한 TMZ의 효능을 상승적으로 향상시킵니다 [ 115 ]
이는 병용 요법이 TMZ 효능을 개선하고 내성을 극복하기위한 하나의 전략 일 수 있음을 시사합니다.
전반적으로 2-FPA는 GBM에 대한 잠재적인 치료제입니다.
이러한 결과를 확장하려면 생리 학적 연구가 필요합니다.
GSC : glioma stem-like cell 교종 줄기 유사세포
GBM : Glioblastoma, 교모세포종
ERK : extracellular signal-regulated kinase 세포 외 신호 조절 키나제
신경 교종에 대한 약물 재배치 문제
가장 큰 문제는 후보 약제를 포함한 분자의 통과를 제한하는 혈액 뇌 장벽 (BBB)의 침투입니다.
BBB는 뇌의 환경을 조절하기 위해 혈액과 뇌 조직 사이의 다층 장벽입니다.
BBB는 신경 세포에 필요한 영양소에 대한 투과성이 우수합니다 [ 116 ].
또한 BBB는 신경 흥분성 아미노산과 같은 신경 전달 물질의 이온 조성과 농도를 조정하여 시냅스를 위한 최적의 환경을 유지합니다.
이온과 신경 전달 물질이 제어되지 않는 방식으로 CNS로 퍼지면 시냅스가 충분히 자극되지 않고 뇌 조직이 손상됩니다 [ 116 ].
BBB는 또한 신경 독성 분자를 배제하기 위해 400–500 Da 이상의 거대 분자의 침투를 방지합니다.[117 ].
일부 혈장 단백질은 신경 세포의 세포 사멸을 유도합니다 [ 116 ].
이 다층 장벽은 이러한 단백질을 차단하고 후보 물질의 침투를 차단합니다.
일부 연구에서는 초음파 민감성 나노 입자 복합체를 사용하는 새로운 약물 전달 시스템을 조사했습니다.
예비 연구에서는 미세 기포가 있는 초음파가 BBB를 국소적으로 열 수 있다는 것이 밝혀졌습니다 [ 118 ].
악성 신경 교종은 다른 악성 종양과는 다른 특징을 가지고 있습니다.
첫째, 악성 신경 교종은 이질성을 가지고 있습니다.
악성 신경 교종은 한때 "다형교모세포종"이라고 불리는 복잡한 집합체입니다 [ 121 ].
한 후보 물질이 일부 신경아 교종 세포에 치료 효과를 발휘하면 다른 내성 신경아 교종 세포가 증식합니다.
이 문제를 극복하기 위해 여러 이전 연구에서 다중 약물 병용 요법을 수행했습니다.
이 치료는 최소한의 부작용으로 한 번에 여러 치료 목표에 초점을 맞출 것 [ 85]
그러나 현재 치료법을 대체 할 수 있는 병용 치료법은 없습니다.
둘째, 임상적 공격성에도 불구하고 악성 신경 교종 종양 세포의 60 ~ 70 %가 비 증식 단계에 있습니다 [ 122 ].
이는 휴지기 세포가 화학 방사선 요법에 대한 내성을 나타 내기 때문에 이질적인 세포뿐만 아니라 세포 주기도 고려해야 함을 의미합니다 [ 122 ].
이를 바탕으로 일부 연구는 세포주기의 위상을 바꿀 수있는 후보 물질에 초점을 맞추고 있습니다 [ 18 , 45 ].
GSC (glioma stem-like cell) 신경교종 줄기 유사세포는 신경교종의 재발의 원인이며 중요한 타켓입니다. [ 100 ]
저농도에서 GSC에 세포독성을 나타내는 약물이 좋은 후보가 될것입니다.
낮은 약물 농도는 부작용을 최소화 할 수 있습니다.
전향적 코호트 연구에서 정신 분열증 환자의 암 발병률이 낮다는 사실이 밝혀졌습니다 [ 123 ].
이로 인해 항 정신병 약물이 신경 교종을 포함한 암에 대한 치료 효과가 있다는 아이디어를 얻었습니다 [ 57 , 62].
악성 신경 교종의 주요 표적 분자는 악성 표현형을 유지하는 Akt, ERK 및 STAT3입니다 [ 62 , 103 , 113 ].
나의 의견
신경교종 치료를 위한 약들을 살펴보니 여전히 난제를 갖고 있는것 같습니다.
세포실험과 동물실험에서는 효과가 있었으나 임상시험에서는 효과가 없거나 미미한 사례가 많은것 같습니다.
아마도 신경교종세포의 특이성 때문인것 같은데 이질성이라 불리우는, 즉 모여 있는 세포들이 순수하지 못한, 다양한 집합체로 어떤 약에 반응을 보이다가도 또 다른 세포들은 반응이 없는 현상을 나타내는것 같습니다.
또한 방사선과 화학 요법으로 인한 공격에 비증식 단계, 즉 숨죽이고 있는 상태를 만드는데 치료에 애로가 있는것 같습니다.
본 논문은 비교적 최근( 2020년 7월 발표)에 정리된 내용들입니다.
대체약물들을 살펴 보았는데 그 중 제법 의미가 있어 보이는 약들은 발프로산, 레베라세탐, 클로로퀸, 펜타미딘, 플루복사민, 플루스피릴린, 에리불린과 다중 약물 병용 요법입니다.
나머지 약들도 그 효과가 경우에 따라 다른데 앞으로의 연구가 더 기대된다고 합니다.
즉 아주 의미 없지는 않다는 말인것 같습니다.
이버멕틴
다음으로는 지난번에도 다루었던 이버멕틴에 관련된 내용을 요약해 봅니다.
보다 상세한 내용들은 아래를 클릭해서 보시기 바랍니다.
이버멕틴과 교모세포종 치료
소아 뇌종양의 종류 sev.iseverance.com/dept_clinic/cancer_center/neuro_oncology_center/treatment/view.asp?con_no=73408&page=&SearchField=&SearchWord= 수모세포종 (Medulloblastoma) 15~20% 차지, 어른에..
blog.daum.net
뇌종양에 이버멕틴이 효과가 있다는 연구들
미토콘드리아 기능장애 및 산화스트레스를 유도하여 교모세포종의 혈관신생, 성장 및 생존을 억제.
-U87 및 T98G 교모세포종 세포. 이종 이식 마우스 모델에서 성장을 크게 억제
-뇌 미세 혈관 내피 세포 (HBMEC)에서 혈관 신생을 효과적으로 표적으로 삼습니다.
-Akt, mTOR 및 리보솜 S6의 인산화를 억제하여 Akt / mTOR 경로를 비활성화시키는 억제 역할을 한다.
-교모세포종에서 미토콘드리아 대사를 표적으로 하는 치료적 가치.
AKT/mTOR 신호전달 경로를 통해 자가포식 매개 세포사멸을 유도합니다.
-IVM과 CQ를 병용한 치료가 IVM 단독 치료에 비해 종양 성장에 대한 억제 효과가 크다.
-IVM 및 자가 포식 억제제와의 병용 요법이 IVM의 항 신경 교종 활동을 향상 시켰다.
RNA helicase 억제제 ivermectin은 DDX23 매개 miR-21 생물 발생 및 신경 교종 세포 증식을 차단합니다.
-최근 연구에 따르면 ivermectin은 RNA helicase 억제제입니다.
-ivermectin이 DDX23의 pri-to-pre-miR-21 처리 활성을 억제하고 신경 교종 세포 증식을 감소시킨다
-우리의 결과는 항암 치료제로 ivermectin의 가능한 적용을 강력하게 제안합니다.
-결론적으로, 본 연구는 DEAD-box RNA helicase, DDX23의 새로운 역할을 분명하게 보여줍니다.
-기존 보고서와 함께 우리의 연구 결과는 다양한 암의 종양 형성에서 DDX23의 역할에 대한 통찰력을 제공합니다.
-더욱이, 이버멕틴의 생체 내 치료는 DDX23 / miR-21 신호 전달을 표적으로 하는 약리학적 이점을 입증한다.
miR-21에 의한 Spry2의 하향 조절은 인간 교종에서 악성 종양을 유발합니다
-비정상적인 miR-21 발현은 교종, 결장, 유방, 전립선, 췌장 및 위 종양을 포함한 다양한 종양에서 나타났다 .
-이러한 종양에서 증가된 miR-21 발현은 세포 증식, 이동, 침입 및 전이와 관련이 있다.
-이 연구에서 우리는 HA- 유도된 miR-21이 Spry2를 표적으로하여 신경 교종 침입을 강화했음을 보여주었다.
-따라서, 우리의 결과는 miR-21에 의한 Spry2의 하향 조절이 신경 교종의 악성을 유발하는 핵심 이벤트이며 Spry2를 악성 신경 교종에서 새로운 종양 억제제로 연루시킨다는 것을 시사합니다.
The Cancer Genome Atlas에 의해 교모세포종에서 확인된 개별 유전적 변화의 빈도는 55 % 미만입니다 (예 : EGFR, 45 %; PTEN, 36 %; ARF, 49 %; P16 / INK4A, 52 % 및 CDKN2B, 47 %).
The Cancer Genome Atlas는 Spry2 단백질 수준을 확인하지 않았기 때문에 인간 신경아 교종 조직의 79.7 %에 달하는 단백질 수준이 변경된 이 유전자를 인식하지 못했습니다.
Ras / MAPK 신호가 음성 조절인 Spry2를 통해 교종의 악성 종양에 중요한 역할을 한다는 것을 발견했습니다.
소아 중추 신경계 신생물에서 혈액 뇌 장벽의 특성
-소아 종양에서의 BBB 분해는 정상적인 내피 세포-성상 세포 발 과정 관계의 상실에 해당한다.
-이 파괴된 BBB를 이용하는 약제의 추가 개발은 수모세포종 및 교모성 성상 세포종에서 보증된다.
-그러나, BBB 무결성은 2 차 교모세포종으로 진행하기 전에 저급 확산 성상 세포종을 치료하는데 있어 여전히 도전 과제이다.
혈액-뇌 장벽에서 P-당단백질 기능 : 연령과 성별의 영향
-BBB에서 가장 중요한 운반체 중 하나는 MDR1/ABCB1에 의해 인코딩되고 ATP-결합 카세트 운반체의 패밀리에 속하는 다제 내성 단백질 P-당단백질 (P=GP)이다.
-Pgp는 간, 신장, 고환 및 BBB와 같은 배설 및 / 또는 장벽 기능이 있는 장기 또는 조직에 인체 전체에 위치합니다.
-알츠하이머의 경우 여성이 더 높은데 이는 호르몬 차이도 있지만 나이가 들며 P-GP기능이 떨어짐에도 영향이 있는 듯.
-연령의 증가로 P-GP 기능이 감소하면 노인에서 BBB를 통과할 수 있는 약물의 독성 증가 및 CNS 부작용 증가.
-젊은 남성에 비해 젊은 여성의 P-GP 기능이 감소한 것으로 나타남.
최적의 약물 전달을 위한 P-당단백질 억제
-인간의 P-GP 는 2 개의 이소형을 갖는 작은 유전자 패밀리를 형성한다.
-클래스 I 이소형 (MDR1 / ABCB1)은 약물수송체인 반면, 클래스 II 이소형 (MDR2 / 3 / ABCB4)은 포스파티딜콜린을 담즙으로 수출합니다.
-단일 P-gp 분자는 분자량 250g/mol (시메티딘)에서 1202g/mol (사이클로스포린)에 이르는 광범위한 화학 구조를 갖는 수많은 약물을 인식하고 수송할 수 있다.
-P-gp는 또한 간세포 및 신장 세관에서 인접한 관강내로 약물의 배설을 향상시키는 역할을 한다.
-P-gp는 암 세포에서 과발현되고 종양에서 약물 유출을 담당한다.
-화학요법제의 세포 내재화를 막고 화학 요법을 거의 비효과적으로 만듭니다.
Ivermectin은 EGFR / ERK / Akt / NF-κB 경로를 통해 암 세포의 약물 내성을 역전시킵니다
-빈크리스틴 및 아드리아 마이신에 각각 내성인 2 개의 고형 종양 세포주 (HCT-8 결장암 세포 및 MCF-7 유방암 세포) 및 1 개의 혈액학적 종양 세포주 (K562 만성 골수성 백혈병 세포)를 사용.
-명백한 세포 독성을 유도하지 않은 매우 낮은 용량의 이버멕틴이 시험관 내 및 생체 내 둘 다에서 화학 요법 약물에 대한 종양 세포의 저항을 크게 역전 시켰음을 나타냈다 .
-P-gp 활성 직접 억제가 아니라 표피성장인자 수용체 (EGFR)를 억제해서 P-gp의 발현을 감소, 주로 저항을 역전시켰다.
-EGFR의 세포 외 도메인과 결합하여, EGFR 및 그 하류 신호 전달 캐스케이드 ERK / Akt / NF-κB의 활성화를 억제하였다.
-전사 인자 NF-κB의 억제는 P-gp 전사를 감소시켰다.
-결과적으로 이버멕틴이 특히 약물-내성 세포에서 화학요법 약물의 종양세포에 대한 항암 효능을 유의하게 향상 시켰음.
-따라서 이버멕틴은 암, 특히 약물 내성 암을 치료하기 위해 화학 요법제와 조합하여 사용될 수 있다.
니클로사미드
신경 교종 (glioma) -총론
-니클로사미드가 교모세포종 세포 생존력을 선택적으로 억제하는 것을 발견했다 [29] .
-니클로사미드가 Wnt, Notch, mTOR 및 NF-κB 신호 전달 경로를 억제한다는 것을 보여주었다.
니클로사미드에 대한 사전 노출은 생체 내 신경 교종 세포의 악성 잠재력을 크게 감소 시켰다.
인간 교 모세포종 종양구에 대한 니클로사미드와 테모졸로미드의 결합 효과
-복합 약물의 생체 내 항암 효능은 마우스 동소 이종 이식 모델에서 테스트
-niclosamide와 temozolomide의 병용 치료는 GBM TS의 세포 생존력, 줄기 및 침습적 특성을 유의하게 억제
-병용 치료는 상피 중간 엽 전이 관련 마커 인 Zeb1, N - cadherin 및 β -catenin의 발현을 크게 하향 조절
-2020년 7월 연세대 뇌종양센타 논문
인간 교모세포종 종양구에 대한 니클로사미드와 테모졸로미드의 결합 효과
인간 교모세포종 종양구에 대한 니클로사미드와 테모졸로미드의 결합 효과 link.springer.com/article/10.1007/s00432-020-03330-7#:~:text=Glioblastoma%20(GBM)%20is%20the%20most,surgery%2C%20radiothe..
blog.daum.net
메벤다졸
Temozolomide를 투여받은 새로 진단된 고등급 신경 교종 환자의 Mebendazole
clinicaltrials.gov/ct2/show/record/NCT01729260
-메벤다졸 (Mebendazole) : 500mg 씹을 수있는 정제, 식사 포함, 매일 3 회 28 일주기
-연구 기간 : 2013 년 4 월 4 일 ~ 2025 년 9 월
-위치 : The Johns Hopkins Hospital, Baltimore, Maryland, United States
재발성 / 진행성 소아 뇌종양에 대한 메벤다졸 요법의 1 상 연구
-Mebendazole : 500mg 씹을 수있는 정제, 식사와 함께 3 회 나누어 복용
-연구 기간 : 2016 년 5 월 ~ 2022 년 6 월
-위치 : Johns Hopkins All Children 's Hospital
소아 교종 치료를 위한 메벤다졸의 1 상 연구
-Mebendazole : 50, 100 및 200 mg / kg / day,
-저 등급 신경 교종 환자의 경우 70 주 동안 po 및 bd, 고급 신경 교종 환자의 경우 48 주
-연구 기간 : 2013 년 10 월 22 일 ~ 2020 년 4 월
-위치 : Cohen Children 's Medical Center of New York, New Hyde Park, New York, United States
temozolomide 내성 교모세포종 multiforme의 두개 내 이종 이식 모델은 mebendazole에 잘 반응했지만 albendazole에는 반응하지 않았습니다
벤즈이미다졸 구충제의 용도 변경 약물로서의 항 종양 가능성
벤즈이미다졸 구충제의 용도 변경 약물로서의 항 종양 가능성 The Antitumor Potentials of Benzimidazole Anthelmintics as Repurposing Drugs www.ncbi.nlm.nih.gov/pmc/articles/PMC7458798/#S2 미국 Florida A..
blog.daum.net
이트라코나졸
www.tandfonline.com/doi/full/10.4161/auto.28912
-이트라코나졸은 자가포식 유도를 통해 교모세포종의 성장을 억제합니다
-이트라코나졸은 AKT1-MTOR 경로의 억제를 통해 자가포식을 유도합니다.
-이트라코나졸 매개 세포 콜레스테롤 재분배와 교모세포종 세포에 대한 항 증식 효과 사이의 연관성을 정의했습니다.
-자가 포식의 억제는 이트라코나졸의 세포 독성을 감소시키며, 이는 자가 포식 유도제를 사용하면 이트라코나졸의 잠재적인 항암 활성을 향상시킬 수 있음을 시사합니다.
이트라코나졸 항암효과 종합
난소암, 전립선암, 유방암, 폐암, 기저세포 암종, 췌장암, 담도암, 균 상식 육종, 급성 백혈병에 이트라코나졸 임상 논문이 있으며 지속적인 사용으로 향상된 생존률과 개선된 결과가 보였다. 사
blog.daum.net
니타조사나이드
신경교종에 대한 효과를 보면 말기자가포식을 억제하고 교모세포종에서 ING1 유발 세포주기 정지를 촉진한다 입니다.
먼 말이죠? 일단 자가포식은 암세포가 생존하는 방법중에 하나입니다. 이걸 억제하는건, 즉 암을 고립 시키는 것 입니다.
그리고 ING1은 성장억제제 단백질1을 만드는 유전자입니다. p53 신호전달 경로의 구성요소입니다.
NTZ이 세포가 성장하는걸 억제한다는 것입니다.
즉 NTZ는 신경교종세포 생존력 및 증식을 감소시킵니다.
NTZ와 클로로퀸의 조합은 교모세포종에 대한 세포독성 효과를 향상시켰다.
특히 BBB를 침투할수 있기에 저용량에서도 효과를 볼 수 있을 것으로 생각합니다.
클로로퀸 CQ
신경 교종 및 뇌 전이
1998년 5월, 암에서 CQ 사용에 대한 최초의 임상 시험 중 하나가 시작되었으며, 이는 18명의 다형성 교모세포종 (GBM) 환자를 대상으로 한 공개, 전향적, 무작위 대조 연구였습니다 [ 38 ].
테스트 그룹은 병변 절제 후 매일 150mg CQ를 받은 9 명의 환자로 구성되었으며, 방사선 요법 (총 선량 6000Gy)과 6 주마다 4주기 (200mg / m2)의 카무스틴 화학 요법을 받았습니다.
대조군의 9 명의 환자는 CQ 대신 위약을 투여 받았습니다.
이 연구의 초록에서 저자들은 보조제 CQ 투여가 환자 생존율을 크게 향상 시켰다고 보고했습니다 [CQ 치료 환자의 경우 33 ± 5 개월, 대조군의 경우 11 ± 2 개월 (p <0.0002)].
두 번째 연구에서, 15명 GBM 환자들은 기존의 항암 치료, 카무스틴 화학 요법의 4 개 주기 매 5주 하였다
대조군의 11 개월과 비교하여 CQ 처리 그룹에서 24 개월의 중앙 생존 시간이 관찰되었습니다.
또한 사망에 대한 위험 비율은 통계적으로 유의하지 않았지만 CQ를 받은 환자의 약 절반 정도였습니다.
이 시험에서 중요한 부작용은 발견되지 않았습니다.
후향적 연구에서 동일한 연구 그룹은 보조 CQ 치료를 받고 앞서 언급한 임상 시험에 참여하지 않은 멕시코의 41 GBM 환자로부터 5 년 동안 수집된 데이터를 조사했습니다 [ 41 ].
이 CQ 치료 환자의 평균 생존 시간은 82 명의 교모세포종 환자의 대조군에 비해 유의하게 더 길었습니다.
하루 250mg CQ로 치료하고 20개월 동안 반복 조사한 5명의 GBM 재발 환자 5명의 유망한 결과를 관찰한 후, 2상 임상 시험에서 뇌 전이 환자에서 CQ가 방사선 민감제로서의 효과를 테스트 했습니다.[43].
이 시험에서 39명의 환자에게 4주 동안 150mg CQ의 일일 투여량과 함께 뇌 전체 방사선을 투여한 반면 34 명의 환자는 동일한 방사선에 CQ 대신 위약을 투여했습니다.
CQ 투여 후 전반적인 반응률이나 OS는 개선되지 않았습니다. 그러나 뇌 전이의 무진행 생존율은 증가했습니다 .
고형 종양에서 뇌전이 20 명의 환자의 예비 단일 코호트 연구에서 250 mg을 매일 CQ 전체 뇌 방사선 치료와 조합하여 다섯 주 동안 투여한 두개 내 반응률은 3개월의 전뇌 조사 후 93 %의 객관적인 임상 반응에 해당하고, OS에 약간의 긍정적인 경향이 있었습니다.
마지막으로 2 건의 사례 보고에서는 CQ와 방사선을 병용한 후 비정상적인 피부 반응을 언급하여 CQ의 방사능 민감 효과를 설명했습니다 [ 45 , 46 ].
재발성 BRAF V600E 돌연변이 뇌간 신경교종이 있는 소아 환자에서, 적어도 30개월 동안 매일 150mg CQ로 치료한 후 종양 성장이 차단되고 베무라페닙 민감도가 회복되었습니다 [ 47 , 48 ].
같은 연구팀은 보고된 시험관내 및 생체 데이터 자식 작용 억제 내성 암세포에 BRAF 억제에 대한 후천적 내성을 가진 두 명의 환자에게 CQ를 투여했습니다.
첫 번째 환자는 큰 원발성 병변의 초점 방사선 동안 표준 용량의 베무라페닙과 매일 250mg의 CQ로 치료를 받았습니다.
베무라페닙을 계속 투여하고 방사선 완료 후 CQ 용량을 매일 500mg으로 증가 시켰습니다.
병용 요법에 대한 빠른 임상 반응은 6주 만에 관찰되었으며 7개월 동안 유지되었으며, 이 시점에서 환자는 관련 없는 의학적 문제로 치료를 중단해야 했습니다.
두 번째 환자는 베무라페닙의 표준 투여와 함께 매일 500mg CQ로 치료 받았습니다.
획득한 베무라페닙에 대한 내성은 CQ 첨가 후 4 주 이내에 극복되었고 2 개월 반 동안 유지된 임상적 개선이 관찰될 수있었습니다.
항암제로서의 클로로퀸 및 하이드록시 클로로퀸
ReDO (Repurposing Drugs in Oncology)-항암제로서의 클로로퀸 및 하이드록시 클로로퀸 www.ncbi.nlm.nih.gov/pmc/articles/PMC5718030/ 클로로퀸 (CQ) 및 하이드록시 클로로퀸 (HCQ)은 잘 알려진 4-아미노퀴놀린..
blog.daum.net
클로로퀸은 상당히 많은 임상과 연구가 되어있습니다. 의미가 있어 보입니다.
다른 세포실험과 쥐 실험만 있는 약들과는 다르게 임상연구도 많이 한것이 중요한 약입니다.
종양학에서 약물 재배치 : 각종 암 치료에 응용되는 약과 임상시험
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7010222/
뇌암 즉 교모세포종에 효과가 있고 관련 임상시험이 있는 약들만 요약함
| 약물명(약 종류) | 주요 용도 | 잠재적인 항암 치료 응용 | 임상시험 식별자 |
| 클로르프로마진 | 정신병 | 신경아 교종, 신경 모세포종, 백혈병, 림프종, CRC, 유방암 및 간암 | NCT03021486 |
| 클로미프라민 | 우울증 및 기타 정신장애 | 신경 교종, 성상 세포종 | - |
| 독시사이클린 | GBM, 흑색 종, 유방암, 난소암, 폐암, | NCT02775695 | |
| 클로로퀸 |
말라리아, 루푸스, 무균증, 류마티스 관절염 |
GBM, 비소세포 폐암, 췌장암 및 유방암 | NCT03243461 |
| 디설피람 | 알코올 억제 |
GBM, CRC, 흑색종, 전립선암, 난소암, 유방암, 췌장암 및 간암 |
NCT03323346 |
| 페노피브레이트 | 고중성지방혈증 및 혼합 이상지질혈증 | 수모세포종, 유방암 및 폐암 | NCT01356290 |
| 넬피나비르 (HPI) | AIDS |
골수종, 육종, GBM, 흑색종, 두경부암, 췌장암, 유방암, 폐암, 갑상선암 및 전립선 암 |
NCT01065844 |
| 리토나비르 (HPI) | AIDS | 다발성 골수종, 신경 교종, 유방암, 만성 골수성 백혈병 | NCT01009437 |
| 이트라코나졸 | 항진균제 | 비소세포 폐암, GBM, 수모세포종, 기저 세포암, 유방암, 폐암, 전립선암, 난소암 및 췌장암 | NCT00769600 |
| 디클로페낙 (NSAID) | 해열제, 항염증제, 진통제 | 신경 교종, 피부암 | NCT04091022 |
| 이부프로펜 (NSAID) | 해열제, 항염증제, 진통제 | 신경아 교종, 신경 모세포종, 결장 직장암, 전립선암, 방광암, 유방암, 폐암 및 위암 | NCT02141139 |
| Vardenafil (PDE5I) | 발기 부전 | 신경 교종 및 뇌 전이 | NCT02279992 |
| 발프로산 | 항 경련제, 양극성 장애, 편두통 | 림프종, 골수성 백혈병, 결장 직장암, 신경 교종, 갑상선암, 자궁 경부암, 방광암, 두경부암, 전립선암 및 췌장암 | NCT00670046 |
시메티딘
시메티딘의 항 종양 작용은 항 증식 작용, 면역 조절 효과, 세포 접착에 미치는 영향, 항 혈관 신생등이 있다.
그 중 교모세포종에 대한 효과는 세포접착에 대한 효과가 입증되었다. [ 31 ]
항암 치료에 있어 상당히 중요한 약인데 전반적인 시메티딘의 내용은 다음을 참고하기 바란다.
항암제로서의 시메티딘
시메티딘은 위산을 줄여주는 위장약입니다. 그런데 이 시메티딘이 용도외로 많은 효능을 가지고 있음이 밝혀졌습니다. 시메티딘은 기존 화학 요법제를 포함한 다양한 다른 약물과 시너지 효과
blog.daum.net
피르비늄
피르비늄은 인간 교모세포종 뇌종양-개시 세포에서 CD133을 표적으로합니다.
http://www.ncbi.nlm.nih.gov/pubmed/26152745
-CD133 (Prominin 1, PROM1)은 인간 암 세포 유형에서 고도로 발현되는 막 관통 단백질입니다.
-CD133 은 또한 암 진행 및 환자 결과와 관련된 암 줄기 세포 (CSC) 마커 역할을 합니다.
-세포 표면 마커 CD133의 발현에 의해 확인된 교모세포종-개시 세포 (GIC)는 화학 방사성 저항성을 보인다.
-두개 내 GIC 이종 이식 및 생존 연구에서 평가되었고 마지막으로, 피르비늄 처리된 GIC에서 마이크로 어레이 분석을 수행하여 관련된 핵심 신호 이벤트를 발견.
-피르비늄은 GIC 자가 재생의 소분자 억제제.
Z-ajoene
-마늘 추출물에서 발견되는 유기 황 화합물
-다형성 교모세포종 (GBM)에서 암 줄기세포 구체 형성 능력을 억제하는 것으로 확인됨.
-Z-ajoene 처리 후 Notch-, Wnt- 및 Hh 관련 유전자가 변경됨. 정상 세포에서 세포 독성을 유발하지 않았다.
-마늘을 으깨거나 잘게 썰면 알리신이 방출되고 식용유를 포함한 다양한 용매에 재료가 용해되면 아조 엔이 형성됨.
-Ajoene은 마늘의 마세레이트 (식용유에 다진 마늘)에서 가장 안정적이고 풍부합니다.
비타민C 정맥주사
방사선 + 테모졸로미드 + Vit.C inj
생체 내 2상 ( NCT02344355 ) 진행 중 / 2023 년 12 월
'암 종류별 총정리 > 기타 암 종류별 정리' 카테고리의 다른 글
| 유잉 육종 Ewing's sarcoma (0) | 2021.08.17 |
|---|---|
| 인간 교모세포종 종양구에 대한 니클로사미드와 테모졸로미드의 결합 효과 (0) | 2021.03.11 |
| 두 경부 편평 세포암 (HNSCC) (0) | 2021.01.30 |
| 폐암 Lung cancer (0) | 2021.01.08 |
| 육종암 Chondrosarcoma. 혈관육종 anigiosarcoma (0) | 2020.12.26 |