전문의약품으로 국내 제약사에서 말라리아 치료제로 다수 생산되고 있습니다.
대표적인 이름으로는 클로퀸정 (명인제약), 말라클로정 (신풍제약), 클로퀸정(명인제약)등이 있습니다.
주성분은 황산 히드록시 클로로퀸이며 100mg~400mg 정제가 생산됩니다.
ReDO (Repurposing Drugs in Oncology)-항암제로서의 클로로퀸 및 하이드록시 클로로퀸
www.ncbi.nlm.nih.gov/pmc/articles/PMC5718030/
클로로퀸 (CQ) 및 하이드록시 클로로퀸 (HCQ)은 잘 알려진 4-아미노퀴놀린 항말라리아제입니다.
CQ와 HCQ는 암세포와 종양 미세 환경 모두에 영향을 미칩니다.
자가 포식 플럭스의 억제 외에도 CQ 및 HCQ의 가장 많이 연구된 항암 효과인 이 약물은 암세포에서 Toll-like 수용체 9, p53 및 CXCR4-CXCL12 경로에 영향을 미칩니다.
흥미롭게도 종양 기질에서 CQ는 종양 혈관계, 암 관련 섬유 아세포 및 면역계에 영향을 미치는 것으로 나타났습니다.
CQ와 HCQ가 항암 활성을 어떻게 발휘 하는지에 대한 여러 가설이 제안 되었습니다.
대부분의 연구는 암세포에 대한 이러한 약물의 직접적인 작용을 보고 했지만 최근 연구에서도 종양 미세 환경에 대한 CQ 및 HCQ의 중요한 영향을 언급했습니다.
전임상 연구에 따르면 CQ와 HCQ에는 서로를 보완할 수 있는 여러 작용 메커니즘이 있다고 말하는 것이 안전합니다.
직접적인 항 종양 효과
CQ 및 HCQ의 주요하고 가장 많이 연구된 항암 효과는 자가 포식의 억제이지만, 항 말라리아제의 다른 전임상 입증된 항암 활성에는 TLR9 / 핵 인자 카파 B (NF-κB) 신호 전달 경로인 CXCL12에 영향을 주는 것이 포함됩니다. / CXCR4 신호 전달 경로 및 p53 경로.
초기 발암에서는 오토파지는 종양 억제 역할을 합니다. 암의 진행 단계에서는 종양 성장을 촉진할수도 있습니다.
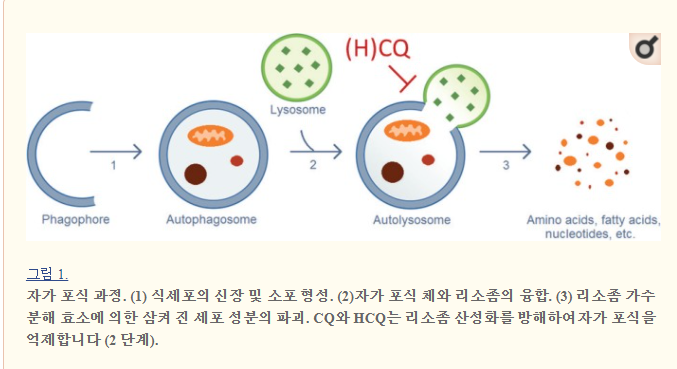
CQ 및 HCQ는 후기 단계에서 자가 포식 플럭스를 억제합니다.
(그림 1) : 자가 포식체와 리소좀의 융합 및 자가 리소좀의 후속 분해.
리소좀에 들어가면 CQ와 HQ는 양성자가 되어 산성 리소좀에 포획되고 리소좀 pH가 증가하여 리소좀 분해 효소를 억제합니다 .
Loehberg 등은 CQ가 PI3K / Akt / mTOR 경로를 수정하여 자가 포식을 조절할 수도 있다고 제안했습니다.
요약하면, 자가 포식은 암에서 이중 역할을 하며 후기 억제제인 CQ 및 HCQ를 사용하는 자가 포식 억제의 성공 여부는 시기와 상황에 따라 달라집니다.
TLR9 / 핵 인자 카파 B 신호 전달 경로의 억제
Toll- 유사 수용체 패밀리의 구성원인 TLR9는 엔도솜 구획에 있습니다.
이 수용체는 메틸화되지 않은 단일 가닥 DNA를 인식하며 병원체 인식 및 타고난 면역 체계 활성화에 필요합니다.
암에서 TLR9의 발현과 자극은 in vitro 실험에서 나타난것 처럼 침습성과 관련이 있습니다 .
처음에 CQ는 엔도좀 산성화를 억제함으로써 이 경로를 억제하는 것으로 생각되었습니다.
그러나 CQ는 TLR에 대한 결합을 방지하기 위해 TLR 활성화를 담당하는 핵산의 구조를 변형시킬 가능성이 가장 높습니다 .
대조적으로, TLR9의 낮은 발현은 삼중 음성 유방암 환자에서 더 나쁜 예후와 관련이 있는 것으로 보고되었습니다.
CQ는 시험관 내 삼중 음성 유방암 세포의 TLR9 상태와는 무관하게 종양 성장 및 침습성에 유망한 효과를 보였지만 생체 내에서 정확한 위치에 이식된 삼중 음성 유방암 종양의 성장을 감소시키지 않았습니다.
CXCL12 / CXCR4 신호 전달의 억제
CXCR4 케모카인 수용체와 그 리간드 CXCL12 사이의 상호 작용은 세포의 화학 주성 및 부착, 성장 인자의 분비에 중요한 역할을 합니다.
CXCL12 / CXCR4 신호 전달과 암 진행 사이의 연관성 .
이러한 상호 작용은 예를 들어 췌장암의 침습성 표현형에 영향을 미친다고 합니다.
2012 년, CQ 및 HCQ와 구조적으로 유사한 CXCR4 소분자 길항제 (NSC56612)가 이 수용체의 in silico 모델링을 통해 확인 되었습니다.
CQ와 HCQ는 in vitro 분석을 통해 췌장암 세포 증식을 억제하는 것으로 밝혀졌습니다 [ 82 , 83 ].
CQ가 CXCL12 / CXCR4 신호 전달을 적어도 부분적으로 억제하는 것으로 나타났습니다.
CQ와 HCQ는 암 줄기 세포에서 CXCR4 내재화를 유도하여 이들 세포가 CXCL12 신호에 덜 민감하게 만듭니다 [ 83 ].
췌장암 환자 유래 이종 이식 모델에 대한 연구에 따르면 CQ는 자기 재생 과정을 억제하여 매우 공격적인 암 줄기 세포를 특이적으로 표적으로 삼는 것으로 나타났습니다.
따라서 CQ는 암 줄기 세포 전이를 차단하는데 유용할 수 있으며 종양의 대부분을 표적으로 하는 다른 항암제 (예 : 젬시 타빈)와 결합될 수 있습니다 [ 83 ].
p53 경로와의 간섭
종양 억제 단백질 p53은 오류없는 게놈을 유지하고 손상이 회복 불가능한 경우 세포 사멸을 유도하는데 필수적인 역할을 합니다.
따라서 이것은 종양 발달을 예방하는 핵심 단백질이다 [84].
in vitro 및 in vivo 연구 모두 CQ가 p53 단백질을 안정화하고 pro-apoptotic 유전자의 p53 의존적 전사를 활성화 할수 있음을 보여 주었습니다 [ 17 , 23 , 24 , 72 , 84 , 85 ].
기본 메커니즘을 설명하기 위해 몇 가지 가설이 제안되었지만 아직 명확한 답은 없습니다.
이러한 가설 중 하나는 CQ가 DNA에 삽입되어 구조적 변화를 일으켜 p53을 유도한다는 것입니다 [ 17 , 85 ].
더욱이, CQ에 의한 p53 활성화는 세포 유형에 따라 운동 실조 모세 혈관 확장증 돌연변이 단백질에 의해 매개될 수 있습니다 [ 17 ,23 , 24 ]
또한 p53 상태와 자가 포식 억제가 암 발생에 미치는 영향 사이의 관계에 대한 논의도 있습니다.
여러 연구에서 p53이 없는 마우스에서 자가 포식이 억제될 때 종양 발달이 가속화 되었다고 보고 하지만 [ 35 , 86 , 87 ] Yang 등은 자가 포식의 억제가 p53 돌연변이 종양에서 여전히 유익한 효과를 가질 수 있음을 보여주었습니다. [ 88 ]
다른 연구에서는 CQ가 p53 경로 및 p53 상태와는 독립적으로 항암 효과를 발휘한다고 확인했습니다 .[ 88 – 90 ]
CQ의 p53에 의존하는 메커니즘과 독립적인 메커니즘 사이의 시너지 효과가 있을 가능성이 높습니다 [ 17 ].
최근 CQ가 종양 억제 단백질 Par-4 분비를 유도하여 암세포의 파라크린 아폽토시스를 유발하고 종양 전이를 억제하는 p53 의존 메커니즘이 보고되었습니다.
이 메커니즘은 p53의 CQ 의존적 활성화와 이후의 Rab8b 유도를 포함하며, 이는 Par-4의 소포를 원형질막으로 수송하는 데 필요합니다 [ 91 ].
더욱이, CQ는 Bcl homology-3-only 단백질 p53 상향 조절된 세포 사멸 조절자 (PUMA)라고 불리는 p53 관련 단백질의 분해를 방지할 수 있습니다.
CQ는 이러한 연구에서 p53에 영향을주지 않고 PUMA 수준을 증가 시켰습니다 [ 20 , 92 ].
다른 잠재적인 행동 메커니즘
CQ는 글루타메이트 탈수소효소 활성에 영향을 미치는 것으로 나타났으며 , 이는 항암 치료에서 잠재적인 작용 기전이 될수 있습니다. [ 94 – 96 ]
메트포르민과 CQ를 사용하여 대사 과정을 억제한다는 가설은 현재 이소시트레이트 탈수소효소 1 및 2 (IDH1 / 2) 돌연변이 연골 육종, 신경아 교종 및 간내 담관암 환자를 대상으로 한 한 임상 시험에서 테스트되고 있습니다 [ 97 ].
CQ와 HCQ는 caspase-3를 활성화하고 CLL, B-cell CLL 및 glioblastoma 세포에서 세포 사멸을 유도하는 Bcl-2 / Bax 비율을 조절할 수 있습니다 [ 17 , 89 , 98 – 100 ].
CQ 매개 세포주기 정지 및 세포 사멸은 유방암 세포에서 관찰되었으며 폴로 유사키나제 1 (Plk-1), ERK1 / 2 Akt 및 세포 분열주기 25C (CDC25C)의 단백질 수준 / 활성 감소와 관련이 있었습니다.
더 높은 CQ 농도는 여전히 아폽토시스와 괴사를 유발하지만 다른 과정을 통해 가능합니다 [ 102 ].
더욱이, HCQ는 히스톤 H3 및 H4의 N- 말단 라이신에서 아세틸화 상태에 영향을 미쳐 인간 유방암 세포 [ 103 ] 에서 볼 수 있듯이 세포 성장과 분화를 조절합니다.
또한 CQ는 Hedgehog 신호에 직접적인 영향을 미칠 수 있습니다.
정상적인 조건에서 이것은 정지 경로이지만 활성화는 종양 형성을 유발하고 암 줄기 세포를 유지합니다.
이 특정 경로를 표적으로 하는 항암 치료 옵션이 연구되었지만 지금까지는 거의 결과를 얻지 못했습니다 [ 104 ].
한 연구는 CQ가 Hedgehog 신호 전달 경로의 단백질 수준을 조절할 수 있다고 제안했습니다 [ 83 ].
CQ는 담관암 세포주에서 나타난 바와 같이 저산소증 유발 인자 1α (HIF-1α), 혈관 내피 성장 인자 (VEGF) 및 상피 중간 엽 전이 (EMT)의 조절을 통해 저산소증 자극 전이를 억제할 수 있습니다 [ 105 ].
삼중 음성 유방암에서 CQ는 Janus-activated kinase 2 및 DNA methyl transferase 1 [ 106 ] 의 발현 감소 또는 미토콘드리아 기능 장애 유도를 통해 암 줄기 세포를 제거하는 것으로 나타났으며 , 결과적으로 산화적 DNA 손상을 유발하고 이중 가닥 DNA 파손 [ 107 ].
여러 연구에서 CQ 투여후 흑색종 세포의 성장 억제가 나타났지만, 이러한 억제는 CQ의 멜라닌에 대한 높은 친화력에 기인할수 있는 색소성 흑색종에서 더 두드러졌습니다 [ 108 ].
Burkitt의 림프종 발생과 CQ 투여 사이의 잠재적 연관성에 대한 모순적인 증거도 있습니다 [ 109 , 110 ].
종양 미세 환경의 조절
면역 조절
흥미롭게도, 자가 포식과 리소좀 기능은 타고난 면역과 적응 면역 모두에 관여하는 것으로 밝혀졌습니다 [ 66 ].
따라서 CQ 및 HCQ와 같은 이러한 과정의 억제제는 잠재적으로 면역 체계를 조절하고 이후에 종양 발달에 영향을 미칠 수 있습니다.
그러나 리소좀 기능과 자가 포식은 항 종양 면역 반응에서 이중 역할을 합니다.
이러한 과정의 활성화는 상황에 따라 면역 반응을 활성화하고 손상시킬 수 있습니다 [ 66].
또한 자가 포식 및 리소좀 기능은 면역계에 대한 종양 세포의 반응에도 영향을 미칩니다.
예를 들어, 종양 세포 자가 포식은 종양 세포 분비물과 표면 프로테옴의 조절을 통해 면역 반응을 유발하는 매개체를 생성할수 있지만 종양 세포가 면역 체계를 벗어나도록 도울수도 있습니다 [ 64 , 66 ].
일반적으로 암세포와 면역계 사이의 상호 작용은 복잡하며 CQ 또는 HCQ 투여가 항 종양 면역과 관련하여 유익한 효과를 가져올 수 있는 시기를 결정하기 위한 추가 연구가 필요합니다 [ 112 ].
이것은 CQ 또는 HCQ가 면역 조절 항암 요법과 함께 사용하도록 고려되는 경우 특히 중요합니다.
종양 혈관계의 정상화
종양에 영양과 산소를 공급하는 종양 혈관계는 종양 미세 환경에서 중요한 구성 요소이며 종양 세포 전이에 필수적인 역할을합니다 [ 113 ].
첫 번째 치료 방법은 종양에 영양분과 산소 공급을 차단하기 위해 혈관을 파괴하는 것입니다.
그러나 축적된 증거는 혈관 정상화 라고도 하는 매우 비정상적인 종양 혈관 구조를 개선하는 것이 항 혈관 신생 요법보다 선호된다는 것을 시사합니다.
혈관 정상화의 이점으로는 종양 저산소증 감소, 암세포 혈관 내 및 전이 감소, 화학 요법 약물 전달 및 반응 증가 등이 있습니다 [ 114 , 115 ].
최근 연구에 따르면 CQ는 혈관 밀도 감소, 세포 정렬 개선 및 밀착 접합 형성을 통해 자가 포식 억제 효과와 관계없이 종양 혈관을 정상화합니다.
분자 수준에서 CQ는 내피 세포에서 엔도좀 Notch1 트래피킹 및 신호 전달을 변경하여 내피 세포의 정지 표현형을 증가시킵니다 [ 26 , 116 ].
참고로, 전신 CQ 투여는 생체 내 신경 교종 모델에서 종양 내 투여된 항 종양제 트랜스페린 -CRM107의 혈관 독성을 감소시키는 것으로 나타났습니다 [ 117 ].
CAF의 중단-암 세포 상호 작용
CQ에 의해 영향을 받을 수 있는 종양과 그 미세 환경 사이의 마지막 상호 작용은 CAF를 포함합니다 [ 118 ].
글루타민과 카베올린-1은 CAF와 종양 세포가 글루타민 생산/ 분비 및 자가 포식 자극을 통해 서로를 지원하는 이 autophagy 매개 상호 작용에서 핵심적인 역할을 합니다.
흥미롭게도이 상호 작용은 CQ의 자가 포식 억제 또는 리소좀 트로픽 활성을 통해 분리될 수 있지만 정확한 메커니즘은 여전히 명확해야 합니다 [ 119 , 120 ].
승인된 항암제와의 시너지 효과
기존의 항암 요법은 종종 암세포에서 프로-생존 자가 포식을 유도하는데, 이는 치료 저항성과 관련이 있습니다.
자가 포식을 억제하는 능력 때문에 CQ와 HCQ는 종양 세포를 화학 요법과 방사선에 민감하게 만들 수 있습니다.
따라서 이러한 약물은 다른 항암 요법과 함께 (전) 임상 연구에서 종종 테스트됩니다.
그러나 다른 항암제와 함께 이러한 항 말라리아 약물을 병용할 때는주의해야 합니다.
자가 포식은 정상 세포에서도 억제되어 원하지 않는 독성 (예 : 신 독성)을 유발할 수 있기 때문입니다 [ 121 ].
항암 요법에 대한 CQ 매개 감작은 또한 자가 포식과 무관한 메커니즘에 기인합니다.
앞서 언급했듯이 화학 요법은 종양 혈관 정상화 후 보다 쉽게 종양 부위에 도달할 수 있습니다 [ 26 , 116 ].
더욱이, CQ는 세포 외 종양 환경과 세포 내 산성 공간을 완충함으로써 양성자화된 화학 요법 약물의 포획을 방지할 수 있습니다 [ 112 ].
예를 들어, CQ는 엔도좀 pH를 높여서 특정 약물의 엔도좀 격리를 감소시켜 그 효능을 증가시킬 수 있습니다 (예 : 독소루비신, 다우노루비신 및 미톡산트론) [ 122 – 124 ].
Vezmar 외는 CQ가 다중 약물 저항성 단백질에 결합함으로써 다중 약물 저항성 단백질 매개 독소루비신 저항성에 영향을 미친다고 제안했다. [ 125 , 126 ].
개별 환자의 효능 예측
종양 세포의 자가 포식 의존성 및 대사 스트레스 수준은 종양 유형 및 진행 단계에 따라 크게 다릅니다.
따라서 자가 포식 억제에 대한 종양 민감도를 예측하는 신뢰할수 있는 측정은 임상 실습에서 환자 선택에 매우 유용할 것입니다 .
앞서 언급했듯이 종양 억제제 p53의 상태는 CQ 효능에 영향을 미칠수 있지만 다른 CQ 민감도 지표도 확인되었습니다.
첫째, EGFR 과발현 종양 세포, 높은 수준의 STAT3 활성, 카베올린-1, Akt 및 Myc- 유도 종양 세포의 손실, 아르기니노 숙시네이트 합성 효소 결핍은 모두 높은 자가 포식 의존성과 관련이 있으므로 CQ 투여에 더 민감합니다 [ 16 , 28 , 119 , 127 – 129 ].
다음으로 종양 세포의 자가 포식 의존성에 대한 발암성 BRAF (V600E) 돌연변이의 효과에 대한 논의가 여전히 있습니다 [ 47 , 130 , 131].
또한 자가 포식이 종양 억제 인자 대체 판독 프레임에 의해 유도된다는 증거가 있지만 CQ 투여가 유익한 효과를 발휘하는지 여부를 결정하기 전에 이것이 세포 독성인지 보호성 자가 포식인지 여부를 명확히 해야 합니다 [ 132 ].
더욱이, 발암성 Ras, 특히 Kras 돌연변이는 자가 포식 의존성 및 CQ에 대한 감수성의 지표로 제안되었지만 [ 27 , 133 ], 다른 두 연구에서는 이 돌연변이가 신뢰할수 있는 지표가 아니라고 보고했습니다 [ 134 , 135 ].
그러나 앞서 언급했듯이 HCQ는 p53없이 발생하는 Ras 기반 췌장 종양에서 종양 성장을 촉진하는 것으로 나타났습니다 [ 35 , 36 ] .
==>CQ. HCQ를 언제 투여해야 할지가 관건이라는 것, 즉 자가포식이 세포독성으로 작용하는지 아니면 스스로를 보호하기 위함인지를 구분할수 있어야 한다는 것인데 앞서 설명되었듯이 자가포식 2단계에서 작용을 하기에 시기와 상황에 따라 달라지는것 같다.
중피종 세포에서와 같이 영양 스트레스의 경우 자가 포식 의존성이 더 높으며 신경 내분비 폐종양 세포는 비신경 내분비 폐종양 세포 보다 자가 포식 억제에 더 민감합니다 . [ 128 ], [ 136 ].
마지막으로, 4개의 인간 신경 교종 세포주를 대상으로 한 시험관 내 연구에서 미토콘드리아 안정성을 나타내는 더 높은 정상 상태 미토콘드리아 막 전위 값이 CQ 치료에 대한 암 세포 저항성을 예측할 수 있음을 관찰했습니다 [ 137 ].
항암 치료에서 CQ와 HCQ의 효능. 용법 용량
CQ 또는 HCQ와의 병용 요법과 기존의 항암 요법은 시험관 내 및 생체 내 에서 전임상 연구에서 광범위하게 연구되었습니다 .
이러한 연구의 대부분은 기존 항암제를 사용한 단독 요법에 비해 개선된 치료 효능을 보고했습니다.
대부분의 연구에서는 CQ와 HCQ가 생존을 위한 자가 포식을 차단함으로써 다른 항암제의 효능을 높일 수 있다고 가정합니다.
전임상 실험에서 다양한 CQ 및 HCQ 용량이 사용 되었지만 대부분의 적용 용량은 인간 용량으로 외삽될 수 있습니다.
임상 시험에 따르면 CQ의 경우 일일 용량은 150 ~ 500mg, HCQ의 경우 일일 용량은 400 ~ 1200mg이 안전하고 잘 견디는 것으로 나타 났지만 두 연구에서 매일 600mg HCQ를 MTD로 확인했습니다.
HCQ는 종종 혈장 변동과 독성을 제한하기 위해 하루에 두 번 투여됩니다.
HCQ는 CQ보다 부작용이 적은 것으로 보고 되었습니다 (예 : 망막 독성 위험이 적음)
따라서 사람이 사용하기 위해 더 많은 용량으로 투여할 수 있습니다.
현재 CQ와 HCQ의 항암 치료 효능에 차이가 있는지 여부는 아직 명확하지 않습니다.
이미 완료된 임상 시험은 CQ가 HCQ보다 더 효과적일 수 있음을 시사합니다.
그러나 이 가설을 확인하기 위한 비교 임상 시험은 설정되지 않았습니다.
지금까지 대부분의 임상적 증거는 교모세포종 및 뇌 전이 환자와 BRAF 돌연변이 환자에서 발견되었지만 폐암, 다발성 골수종 및 육종 환자에서도 일부 유망한 효과가 보고 되었습니다.
CQ 및 HCQ의 부작용은 기존의 항암 요법에 비해 미미하지만 장기간 CQ 및 HCQ 노출을 계획하는 시험에서 망막 독성의 가능성은 안과적 모니터링을 구현해야 합니다.
현재 30개 이상의 임상 연구에서 다양한 암에서 HCQ와 CQ를 평가하고 있습니다. (2017 년 2 월).
그들 대부분은 치료로 유도된 자가 포식의 억제를 통해 다른 항암 요법의 효능을 증가시킬 근거가 있습니다.
CQ
신경 교종 및 뇌 전이
1998년 5월, 암에서 CQ 사용에 대한 최초의 임상 시험 중 하나가 시작되었으며, 이는 18명의 다형성 교모세포종 (GBM) 환자를 대상으로 한 공개, 전향적, 무작위 대조 연구였습니다 [ 38 ].
테스트 그룹은 병변 절제 후 매일 150mg CQ를 받은 9 명의 환자로 구성되었으며, 방사선 요법 (총 선량 6000Gy)과 6 주마다 4주기 (200mg / m2)의 카무스틴 화학 요법을 받았습니다. 2), 대조군의 9 명의 환자는 CQ 대신 위약을 투여 받았습니다.
이 연구의 초록에서 저자들은 보조제 CQ 투여가 환자 생존율을 크게 향상 시켰다고 보고했습니다 [CQ 치료 환자의 경우 33 ± 5 개월, 대조군의 경우 11 ± 2 개월 (p <0.0002)].
보고서의 일부 불일치로 인해 CQ 처리 그룹의 평균 생존 계산이 명확하지 않지만 Kaplan Meier 분석은 여전히 중요합니다.
더 높은 발작 빈도는 CQ 처리 그룹에서 관찰되었으며 설명할 수 없었습니다.
그러나 표준 항 간질 치료는 이러한 발작을 쉽게 억제하는 것으로 보고되었습니다.
같은 그룹의 연구자들이 2000 년 10 월에 유사한 무작위 이중 맹검 위약 대조 연구를 시작했습니다. (39)].
두 번째 연구에서, 15명 GBM 환자들은 기존의 항암 치료, 카무스틴 화학 요법의 4 개 주기 매 5 주 하였다
대조군의 11 개월과 비교하여 CQ 처리 그룹에서 24 개월의 중앙 생존 시간이 관찰되었습니다.
또한 사망에 대한 위험 비율은 통계적으로 유의하지 않았지만 CQ를 받은 환자의 약 절반 정도였습니다.
이 시험에서 중요한 부작용은 발견되지 않았습니다.
후향적 연구에서 동일한 연구 그룹은 보조 CQ 치료를 받고 앞서 언급한 임상 시험에 참여하지 않은 멕시코의 41 GBM 환자로부터 5 년 동안 수집된 데이터를 조사했습니다 [ 41 ].
이 CQ 치료 환자의 평균 생존 시간은 82 명의 교모세포종 환자의 대조군에 비해 유의하게 더 길었습니다.
하루 250mg CQ로 치료하고 20개월 동안 반복 조사한 5명의 GBM 재발 환자 5명의 유망한 결과를 관찰한 후, 2상 임상 시험에서 뇌 전이 환자에서 CQ가 방사선 민감제로서의 효과를 테스트 했습니다. 43].
이 시험에서 39명의 환자에게 4주 동안 150mg CQ의 일일 투여량과 함께 뇌 전체 방사선을 투여한 반면 34 명의 환자는 동일한 방사선에 CQ 대신 위약을 투여했습니다.
CQ 투여 후 전반적인 반응률이나 OS는 개선되지 않았습니다.
그러나 뇌 전이의 무진행 생존율은 증가했습니다 .
고형 종양에서 뇌전이 20 명의 환자의 예비 단일 코호트 연구에서 250 mg을 매일 CQ, 전체 뇌 방사선 치료와 조합하여 다섯 주 동안 투여한 두개 내 반응률은 3 개월의 전뇌 조사 후 93 %의 객관적인 임상 반응에 해당하고, OS에 약간의 긍정적인 경향이 있었습니다.
마지막으로 2 건의 사례 보고에서는 CQ와 방사선을 병용한 후 비정상적인 피부 반응을 언급하여 CQ의 방사능 민감 효과를 설명했습니다 [ 45 , 46 ].
재발성 BRAF V600E 돌연변이 뇌간 신경교종이 있는 소아 환자에서, 적어도 30개월 동안 매일 150mg CQ로 치료한 후 종양 성장이 차단되고 베무라페닙 민감도가 회복되었습니다 [ 47 , 48 ].
같은 연구팀은 보고된 시험관내 및 생체 데이터 자식 작용 억제 내성 암세포에 BRAF 억제에 대한 후천적 내성을 가진 두 명의 환자에게 CQ를 투여했습니다.
첫 번째 환자는 큰 원발성 병변의 초점 방사선 동안 표준 용량의 베무라페닙과 매일 250mg의 CQ로 치료를 받았습니다.
베무라페닙을 계속 투여하고 방사선 완료 후 CQ 용량을 매일 500mg으로 증가시켰습니다.
병용 요법에 대한 빠른 임상 반응은 6주 만에 관찰되었으며 7개월 동안 유지되었으며, 이 시점에서 환자는 관련 없는 의학적 문제로 치료를 중단해야 했습니다.
두 번째 환자는 베무라페닙의 표준 투여와 함께 매일 500mg CQ로 치료 받았습니다.
획득한 베무라페닙에 대한 내성은 CQ 첨가 후 4 주 이내에 극복되었고 2 개월 반 동안 유지된 임상적 개선이 관찰될 수있었습니다.
다발성 골수종
재발성 및 불응성 다발성 골수종 환자 11명을 등록하여 보르테조밉과 사이클로 포스파미드 (하루 2회 경구 투여)에 더해 매일 500mg CQ (1-14 일 및 22-35 일)로 치료했습니다. [ 49 ] .
이 11명의 환자 중 8명만이 평가 가능했습니다.
CQ는 보르테조밉 감수성을 부분적으로 회복시킬 수 있었습니다.
3명의 환자는 부분 반응을 보였고, 1명은 안정된 질병을 보였고, 4명은 최선의 반응으로 진행했습니다.
cyclophosphamide와 prednisone을 병용하여 하루 2회 250 mg CQ의 보조 치료 효과를 38명의 골수종 환자에서 10일 동안 테스트했습니다 [ 50 ].
20명의 환자는 cyclophosphamide와 prednisone을, 나머지 18명의 환자는 CQ와 카페인으로 추가 치료를 받았지만 CQ 치료 환자 그룹에서는 추가 반응이 관찰되지 않았습니다.
HCQ
고형암
HCQ와 템시롤리무스 병용 요법의 효과는 1상 용량 증가 연구 동안 진행된 고형암 환자 27명과 2상 권장 용량으로 전이성 흑색종 환자 13명을 대상으로 테스트 되었습니다 [ 51 ].
객관적인 반응을 경험한 환자는 없었으나 1상 환자 27명 중 19명 (73 %), 흑색종 환자 13명 중 9명 (69 %)이 안정적인 질환을 가지고 있었다.
안정된 질병을 가진 환자에서 HCQ 추가는 종양에 대사 스트레스를 생성하는 것으로 나타났습니다.
환자의 종양 조직 및 말초 혈액 단핵 세포에서 세포당 자가 포식 액포의 수를 계산하여 측정한 자가 포식 억제 (작용 메커니즘 섹션 참조)는 매일 최소 1200mg HCQ를 투여받은 환자에서만 나타났습니다.
이 연구는 하루에 두 번 600mg의 보조제 HCQ 용량을 권장합니다.
다음으로 진행성 고형종양 및 흑색종 암 환자 40명을 대상으로 HCQ와 temozolomide의 병용 효과를 조사하여 1일 2회 600mg의 권장 용량을 확인하였다 [ 52 ].
HCQ는 말초 혈액 단핵 세포에서 자가 포식 액포의 상당한 축적에 의해 입증된 바와 같이 성공적으로 자가 포식을 억제하는 것으로 나타났습니다.
HCQ와 보리노스타트 병용 치료의 안전성과 예비 효능은 진행된 고형 종양 환자 27명을 대상으로 1상 연구에서 테스트되었습니다 [ 53 ].
이 연구에서 최대 내성 HCQ 용량은 400mg 보리노스타트와 함께 매일 600mg으로 설정되었습니다.
신세포암 환자에서 확인된 지속적인 부분 반응이 관찰되었으며, 2명의 대장암 환자에서 장기간 안정된 질환이 관찰되었습니다.
이전 연구와 달리 자가 포식은 크게 영향을 받지 않았습니다.
마지막으로, 파일럿 후향적 연구에서 최대 내성 화학 요법과 1차 메트로놈 화학 요법에 대한 임상 반응이 없었던 25명의 IV기 암 환자를 시롤리무스(2mg /일)와 자가 포식 억제제 HCQ ( 최소 3개월 동안 현재의 메트로놈 화학 요법에 추가하여 400mg /일).
치료법은 비교적 안전한 것으로 보고되었으며 전체 반응률은 40 % 였으며 질병 통제율은 84 % 였습니다 [ 54 ].
==> 좋았다는 말이죠^^
그러나 이것은 신중한 해석이 필요한 후향적 분석이었다.
교모 세포종
HCQ의 효능과 안전성은 1~ 2상 연구에서 92명의 GBM 환자를 대상으로 방사선 요법과 테모졸로미드와 함께 연구되었다.
이 연구는 이 치료 환경에서 하루 600mg HCQ의 최대 허용 용량 (MTD)을 나타냈다.
Stupp에 의해 보고된 시험의 테모졸로미드 군과 비교하여 OS는 영향을 받지 않는 것으로 보였으며 모든 환자에서 자가 포식이 지속적으로 억제되는 것으로 밝혀지지 않았다.
폐암
HCQ와 엘로티닙의 조합은 진행된 비소세포 폐암 (NSCLC) 환자 27명을 대상으로 한 1상 연구에서 결정된대로 150mg의 엘로티닙과 1000mg의 HCQ의 일일 용량으로 안전하게 사용할 수 있습니다 [ 57 ].
연구에 남아 있는 19명의 환자 중 1명은 부분 반응을 보였고 4명은 최상의 반응으로 안정적인 질환을 가졌습니다.
6개월 이상의 기간 동안 HCQ를 복용한 7명의 시험 참가자에 대한 후속 안과 감시는 노출 11개월과 17개월 후 2명의 환자에서 망막 독성이 발생한 것으로 나타났습니다 [ 58 ].
이것은 HCQ를 사용한 임상 시험 중에 망막 독성 모니터링의 중요성을 강조합니다.(고해상도 스펙트럼 도메인 광학 일관성 단층 촬영, 안저 자동 형광 이미징, Humphrey 시야 검사 및 다 초점 전기 망막 조영술을 통해)
다발성 골수종
1상 연구에서 재발성 또는 불응성 골수종 환자 25명을 대상으로 HCQ와 보르테조밉 병용의 안전성을 조사했다.
하루에 두번 600mg HCQ의 용량은 표준 용량의 보르테조밉과 함께 안전하고 견딜수 있는 것으로 보고되었다.
자가 포식 액포수의 증가는 임상 반응이나 HCQ 노출과 유의한 관련이 없었다.
평가 가능한 22명의 환자 중 3명 (14 %)은 매우 좋은 부분 반응을 보였고, 3명 (14 %)은 경미한 반응을 보였으며, 10명 (45 %)은 최소 1주기 동안 안정적인 질환을 보였으며 6명 (27 %)은 즉각적인 진행을 보였다.
췌장암
수술 전 HCQ (1 일 1200mg)와 젬시타빈 투여의 안전성은 1-2 상 시험에서 췌장 선암 환자 35 명에서 입증되었다.
이 연구는 유망한 임상 반응 마커 (예 : CA 19–9 바이오 마커 및 R0 절제율)를 보고했다.
탐색적 분석은 자가 포식이 충분히 억제된 환자에서 무병 생존율 및 OS (각각 15.03 대 6.9 개월 및 34.83 개월 대 10.83 개월)를 보였다.
다음으로, 전이성 췌장암 환자 20명을 대상으로 1일 2회 400mg 또는 600mg의 HCQ 단독 요법의 안전성과 효능을 2상 연구에서 조사했지만 그룹간에 유의한 차이는 관찰되지 않았다.
또한 환자의 림프구에서 LC3B-II 분석에서 알 수 있듯이 autophagy의 억제는 일관되게 달성되지 않았으며 2개월 무진행 생존율은 10 %에 불과했다.
육종
이 연구는 암 관련 섬유 아세포(CAF)와 육종 세포 사이에 대사적 공생 관계가 있다는 가설에서 시작.
1차 치료에 실패한 10명의 육종 환자를 대상으로 2주 동안 1일 2회 시롤리무스 1mg과 HCQ 200mg의 조합을 테스트.
FDG PET 반응 기준에 따르면, 치료 시작 2주 후 6명의 환자가 부분 반응을 보였고 3명은 안정된 질환을 보였고 1명은 진행성 질환을 보였다.
그러나 대부분의 환자는 질병 진행에 대한 초기 계획된 8주 반응 평가전에 치료를 중단했다.
20201.05.04
세포 외 pH가 산성일 경우 클로로퀸의 자가 포식 억제 기능은?
중화된다. 즉 효과가 떨어지는것 같습니다.
http://www.ncbi.nlm.nih.gov/pubmed/24492472
산성 pH는 종양 미세 환경의 중요한 특징이며 종양 진행의 주요 결정 요인입니다.
산성 pH에서 배양된 3 개의 다른 인간 암 세포주에서 자가 포식 플럭스가 CQ에 의해 차단되지 않는 것을 관찰했습니다.
이것은 산성 조건에서 배양된 세포에서 CQ 독성에 대한 완전한 저항성과 일치합니다.
'암 치료 약물 > 클로로퀸, 아르테미시닌' 카테고리의 다른 글
| 아르테수네이트 , 아르테미시닌 관련 논문 요약 (0) | 2021.10.04 |
|---|---|
| 아르테미시닌 항암 임상시험과 사례보고서 (0) | 2021.10.04 |
| 아르테미시닌의 암에 대한 효과와 임상시험 (0) | 2021.05.18 |
| 아르테미시닌 2탄 (0) | 2021.03.17 |
| 아르테미시닌 1탄, 피라맥스(아르테수네이트,피로나리딘) (0) | 2020.12.01 |