피라맥스는 신풍제약에서 만드는 말라리아 치료제 이름입니다.
그 안에 들어 있는 성분은 아르테수네이트 60mg, 피로나리딘인산염 180mg 이 들어 있습니다.
먼저 여기서 아르테수네이트는 무엇인가?
아르테미시닌은 아시나요?
이버멕틴과 함께 노벨상을 받은 약 성분이죠. 쑥에서 추출한 약리성분입니다.
기름과 물에 잘 녹지 않습니다. 그래서 흡수율이 낮고 반감기 또한 짧기 때문에 초기에는 자주 먹어야했습니다.
이것을 개선하기 위해 나온게 아르테수네이트입니다.
아르테미시닌의 유도체, 즉 같은 식구죠.
아르테수네이트는 흡수율을 개선한 성분입니다.
이 또한 반감기가 짧고 작용 지속 시간이 짧습니다.
그리고 또 하나의 성분 피로나리딘.
말라리아 치료를 위한 초기요법으로 아르테미시닌의 부족함을 보충하기 위해 아르테미시닌 병용요법이라는게 시행되었습니다.
단독으로 사용될 수 있었지만 재발이 일어나기 때문에 이를 방지할 목적으로 아르테미시닌 병용요법을 하게 되었고 그 성분 중 하나가 피로나리딘입니다.
1980년 초 중국에서 개발되어 말라리아에 클로로퀸 이상의 효과를 냄을 보고 아르테미시닌 병용요법에 포함되게 되었고 오늘날 말라리아 치료를 위한 가장 효율적이며 저렴한 조합으로 알려지고 있습니다.
자 이제 피라맥스는 상품이름이고 쑥에서 추출한 것이 아르테미시닌이며 아르테수네이트, 피로나리딘은 피라맥스 안에 들어 있는 약성분인 것을 분명히 아시겠죠.
그럼 이제 애들의 항암작용에 대해 알아보겠습니다.
아르테미시닌은 체내에서 암세포의 철분과 반응하고 암세포를 파괴합니다.
철분은 암 세포 증식에 필수적인 요소입니다.
대부분의 암세포는 철분 섭취율이 높고 세포 표면에 높은 농도의 트랜스페린 수용체를 발현합니다.
정상세포는 과산화물을 중화시키는 카탈라아제 라는 효소가 있고 암 세포는 부족합니다.
그래서 정상세포에는 무해한데 암 세포에는 치명적인 것입니다.
암세포는 건강한 세포보다 아르테미시닌으로 죽는데 약 100 배 더 취약합니다.
=p53 DNA 복구 유전자 및 사이클린 의존성 키나제를 조절합니다.
=메틸화 및 히스톤 단백질 아세틸화를 포함하여 중요한 후성 유전학 또는 DNA 침묵을 조절합니다.
=혈관 신생을 억제하여 종양으로의 혈액 공급을 방해합니다.
=시스테인 프로테아제 효소 및 SERCA 유형 칼슘 수송효소를 억제합니다.
=세포사멸 유도. 섬유육종, 림프종, 유방암, 췌장암,식도암, 전립선암 및 난소, 나팔암, 복막암과 같은 암의 성장을 늦춤.
=편평 세포 암종 및 간세포 암 및 원발성 간 전이에 효과적입니다.
=TCM 의사들은 "고온"암에 가장 좋으며 대장 또는 폐 ARTESUNATE의 "금속 원소"암에서는 효과가 적다고 말합니다.
=대장암, 흑색종, 폐암, 진행성 자궁 경부암, 유방암등 각종 암에 효과가 있는 연구들이 있습니다.
그럼 아르테미시닌이 좋을까요? 아르테수네이트가 좋을까요?
둘 다 엄지 척입니다.
다만 아르테수네이트는 체내 흡수율이 개선되었다 했죠? 그래서 BBB 통과를 더 잘한답니다.
반면에 아르테미시닌은 특히 유방암에서 과잉 에스트로겐과 프로락틴을 감소시키는 호르몬 밸런서입니다.
최대 효능을 위한 구체적인 용량은 아직 확립되지 않았습니다.
그러나 일반적으로 하루 400 ~ 800mg을 최소 6 ~ 12개월 동안 사용할 수 있으며 명백한 부작용은 없습니다.
여러분이 궁금해 하시는 피로라니딘
피로라니딘의 항암 효과는 진정한 DNA 삽입제이자 DNA topoisomerase 2의 억제제로, DNA 손상과 세포 사멸을 초래합니다.
P-GP, 즉 P 당 단백질의 기능을 억제함으로써 암세포의 다제내성을 역전시킵니다.
특히 피로라니딘은 암세포에서 미토콘드리아 탈분극과 포스파티딜 세린 외부화를 유도하는 것으로 밝혀졌습니다.
또한 유세포 분석 및 생화학적 방법을 사용하여 PYR에 의한 암 세포의 세포 자멸사 유도를 특징으로 합니다.
항암효과가 있고 주 작용기전이 DNA 손상쪽이네요 와우~
참고자료
https://en.wikipedia.org/wiki/Artemisinin
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6347441/
https://amberlifeclinic.eu/artemisinin-or-artesunate-could-it-be-a-cancer-treatment/
https://onlinelibrary.wiley.com/doi/10.1002/bip.23398
아르테미시닌의 항 종양 효과.
www.ncbi.nlm.nih.gov/pmc/articles/PMC3228295/
| Cmpd | 암/세포주 | 효과 | 메커니즘 | 참조 |
| DHA / ART | 골육종 | 성장 억제 | G 2 / M, 생존율 감소 | [ 73 ] |
| p53 상태가 다른 4 개의 세포주 | 아폽토시스 | Bax 증가, caspase 3,8,9 활성화 감소 Bc12, Cdc25B, cyclin B1, NF- κ B |
[ 44 ] | |
| DHA | 간종 (다른 세포주) | 성장 억제 | G 1 , 감소된 사이클린 D, E, CDK2-4, E2F1 Cip 1 / p21 증가, Kip 1 / p27 |
[ 67 ] |
| 아폽토시스 | Bax / Bcl2 비율 증가, caspase 3 활성화 poly ADP-ribose polymerase 증가 MDM2 감소 |
|||
| DHA / ART | 신경 모세포종 | 성장 억제 | G 1 | [ 52 ] |
| 아폽토시스 | 카스파제 3의 활성화 | |||
| DHA | 췌장 (BxPC3 RFP) | 성장 억제 | G 1 , 사이클린 D1 감소, p21 증가 | [ 74 ] |
| 아폽토시스 | Bax 증가, Bcl2 감소 | [ 74 , 75 ] | ||
| 혈관 신생 | VEGF 감소 | [ 75 , 76 ] | ||
| NF- κ B DNA 결합 감소 | [ 74 , 76 ] | |||
| IL-8, COX2, MMP9 | [ 76 ] | |||
| DHA | Human promyelocytic | 성장 억제 | G 1 | [ 33 , 34 ] |
| 백혈병 (HL-60) | 아폽토시스 | ER 스트레스, c-MYC 저하 | [ 33 ] | |
| 대장 암 (HT116) | GRP78 증가 | [ 34 ] | ||
| DNA 손상 | [ 33 ] | |||
| DHA | 폐암 (SPCA1) | 아폽토시스 | 생존율 감소 | [ 56 ] |
| (PC-14) | 칼슘 수치 증가, p38 MAPK 증가 | [ 57 ] | ||
| (ASTC-al) | 산화 증가, 활성화 caspase 3,9,8 Bax 전위 |
[ 54 ] | ||
| DHA / ARS | 인간 난소 암 (세포 패널, A2780, OVCAR-3) | 성장 억제 | G 2 | [ 69 ] |
| 아폽토시스 | Bax-Bad 증가, Bclx-Bcl2 감소 | [ 69 , 77 ] | ||
| 활성화 카스파 제 3/9 경로 | [ 69 , 77 ] | |||
| DHA | 림프 내피 세포 | 아폽토시스 | Bax 증가, Bcl2 감소 VEGFR-3 / FL-4 감소 |
[ 78 ] |
| DHA | 흑색 종 (A375, G361, LOX) | 아폽토시스 | 산화 스트레스 증가, NOXA 활성화 카스파 제 3 증가 |
[ 79 ] |
| DHA | Jurkat T 림프종 | 아폽토시스 | DNA 손상 산화 증가, NOXA 증가 Bak 증가, caspase 9 활성화 |
[ 80 ] |
| DHA | 섬유 육종 (HT 1080) | 마이그레이션 / 침략 | NF- κ B, AP-1 감소 MMP2, MMP9 활성화 감소 PKC α / Raf / ERK 및 JNK 감소 |
[ 81 ] |
| DHA | 신경 교종 세포 (C6) | 아폽토시스 | HIF 1 α , VEGF 감소 | [ 41 ] |
| DHA | 만성 골수성 백혈병 (K562 세포) | 성장 억제 | G 2 , PCNA 감소, 사이클린 B1, D1, E1 | [ 82 ] |
| CDK2-4, E2F1, DNA-PK, DNA-topo1, JNK VEGF | [ 68 ] | |||
| ART | 혈관 신생 | VECF 감소 | [ 82 ] | |
| DHA | 루이스 폐암 | 혈관 신생 | 감소된 VEGF-C, IL-1 β- 유도 된 p38 | [ 83 ] |
| MAPK 활성화 | ||||
| VEGF 수용체 KDR / flk-1 감소 | [ 84 ] | |||
| DHA / ART | 자궁 경부암 (HeLa) 인간 유두종 바이러스 불멸화 / 형질 전환 된 세포 |
아폽토시스 | 카스파제 9의 활성화 | [ 85 ] |
| ART | 백혈병, 흑색 종, 비소 세포성 폐암, 결장암, 신장암 , 난소 암, 전립선암, CNS; 전립선, 유방암 (NIC 세포 패널) |
성장 억제 | G 0 / G 1 , 감소 된 CDK2, CDC25A G 2 / M, 감소 된 cyclin B1 |
[ 5 ] |
| ART | 자궁내막암 (HEC-1B) | 성장 억제 | G 0 / G 1 | [ 86 ] |
| 아폽토시스 | 카스파 제 3 활성화, COX-2 감소 | |||
| 혈관 신생 | E-cadherin 증가 | |||
| ART | 췌장암 (BxPC3, MiaPaCa-2) | 아폽토시스 | 카스파제 3, 7의 활성화 topoisomerase II a의 억제 |
[ 87 ] |
| ART | 비소 세포 폐암 (SPC-A1) | 전이 | MMP2 감소, AP-1 거래 활성화 | [ 56 , 88 ] |
| NF- κ B | ||||
| uPA 프로모터 | [ 88 ] | |||
| MMP7 | [ 56 ] | |||
| ART | 결장 직장 (CLY, HT29, Lovo) | 전이 | E cadherin 증가 Wnt 신호 전달 경로 감소 |
[ 89 ] |
| ART | 마우스 골수종 세포주 SP2 / 0 | 성장 억제 | G 0 / G 1 | [ 90 ] |
| 아폽토시스 | NF- κ B p65 감소 , I κ B α 증가 | |||
| ARS | 간세포 암세포 (HepG2, SMMC-7721) | 전이 | TIMP2, Cdc42, E 카드 헤린 증가 | [ 91 ] |
| MMP2 감소 | ||||
| 비인두암 계통 (CNE-1 및 CNE-2) | 성장 억제 | G 1 | [ 92 ] | |
| 흑색 종 (A375P, A375M) | 성장 억제 | — | [ 93 ] | |
| 이주 | MMP2, α v β 3 인테그린 감소 | |||
| ATM | 결장 직장 (HCT116, SW480) | 성장 억제 | G 1 , S, G 2 , CDK1 감소 | [ 63 ] |
| 모든 단계 | ||||
| 유방 (MCF-7) | G 1 , CDK4 감소, 사이클린 D1 | |||
약어 : Cmpd : 복합; DHA : 디하이드로 아르테미시닌; ART : 아르테수네이트, ARS : 아르테미시닌, ATM : 아르테미손.
아르테미시닌의 약물 상호 작용.
| 약물 조합 | 암/세포주 | 효과 | 참조 |
| DHA + 테모졸로미드 | 쥐 C6 신경 교종 세포 | 세포 자멸사 증가, ROS 유발에 의한 괴사 | [ 107 ] |
| DHA + 시클로 포스파미드 | 루이스 폐암 | 세포 자멸사 증가, VEGF 수용체 KDR / flk-1 세포 자멸사 감소 |
[ 84 ] |
| DHA + 시스플라틴 | 인간 비소세포 폐암 (A549) | 전이 감소 | [ 84 ] |
| DHA + 젬시타빈 | 췌장 (Panc-1) | 증식 억제, cyclin D1 감소, apoptosis 증가, Bax / Bcl2 비율 증가, caspase 3 활성화 | [ 94 ] |
| 간종 (세포 패널) | 성장 억제 45 % 증가 | [ 67 ] | |
| DHA + 부티르산 | 인간 림프 모세포성 백혈병 (Molt-4) | 시너지 효과. 암세포 고갈 | [ 110 ] |
| DHA + 방사선 | 신경 교종 세포 U373MG |
방사선 유발 GST의 세포 독성 증가 억제 | [ 53 ] |
| DHA + 카보플라틴 | 난소 암 세포 (A2780, OVCAR-3) | 사멸 수용체 및 미토콘드리아 매개 경로를 통한 성장 억제 증가 | [ 77 ] |
| DHA + 트레일 | 전립선 암 (DU145, PC-3, LNCaP) | 외인성 및 내인성 경로의 세포 자멸사 증가 | [ 100 ] |
| ART / DHA + 독소루비신 + 피라루비신 | 백혈병 (K562 / adr) 소세포 폐암 (GLC4 / adr) |
시너지 효과 | [ 4 ] |
| ART+ 레날리도 마이드 | 폐 (A549) 및 유방 (MCF-7) | IC50을 48 % 감소 | [ 111 ] |
| ART + 옥시플라틴 | 콜론 (HT 1116) | 부가적인 . 민감화 효과 | [ 111 ] |
| ART + 젬시타빈 | 유방 (MCF-7) | 부가적인 | |
| 폐 (A549) | 부가적인 | ||
| ATM + 옥시 플 라틴 ATM + 탈리도마이드 ATM + 젬시 타빈 |
결장 (HCTl16, SW480) 유방 (MCF-7) |
모든 첨가제 | [ 63 ] |
| ARS + 고압산소 (HBO2 ) | Molt-4 인간 백혈병 | 22 % 성장 감소 | [ 112 ] |
| ARS + 독소루비신 | 대장 암 (HT29) | NF- κ B의 활성화 / Pgp의 과발현에 의해 매개되는 안타고닉으로 예측됨 | [ 59 ] |
| ARS + 옥시플라틴 | 결장 (HCTl16, SW480) | Antagonism | [ 63 ] |
| ARS + 탈리도마이드 | 부가적인 | ||
| ARS + 젬시타빈 | 유방 (MCF-7) | Antagonism | |
약어 : HBO 2 : 고압 산소.
암에 대한 가능한 치료법으로서의 아르테미시닌과 그 합성 유도체
www.ncbi.nlm.nih.gov/pmc/articles/PMC5872176/
종양 세포를 선택적으로 사멸시킴. 대사 증가, 철분 및 트랜스페린 농도 증가,
반응성 산소종 (ROS)에 대한 감수성. 최소 독성 및 부작용.
=철분 결핍 마우스의 종양이 더 천천이 성장한다는 보고 = 즉 암세포 성장에 철분의 요구
=암세포에 철 또는 철이 포화된 홀로 트랜스페린이 로드된 경우 세포내 철 농도의 증가가 아르테미시닌 세포 독성을 100배 증가시킬 수 있음을 보여주었다.
=암세포는 정상적인 건강한 세포와 비교할때 철분 요구량뿐만 아니라 철 대사율과 트랜스페린 수용체의 발현을 크게 증가시켜 아르테미시닌 세포 독성에 더 취약함.
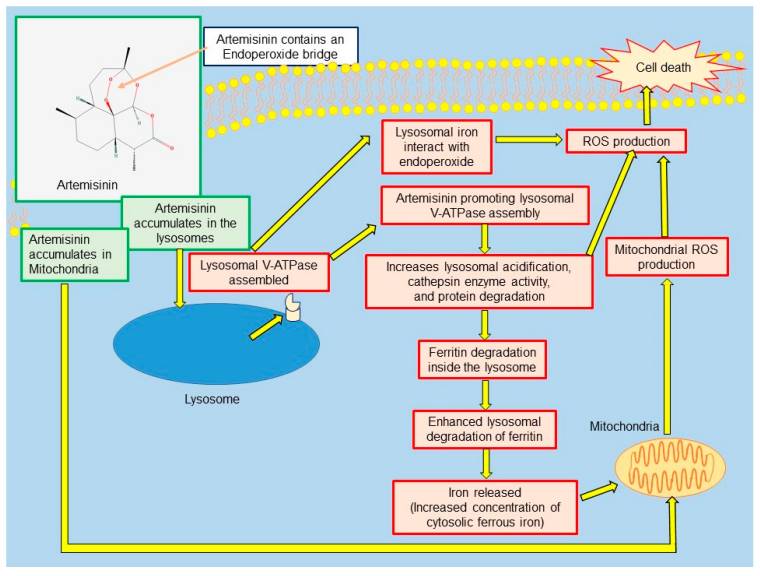
암세포에서 선택적으로 세포 사멸을 유도하는 것으로 가정된 아르테미시닌의 작용 방식.
V-ATPase : 액포형 H + -ATPase; ROS : 반응성 산소종.
=저용량의 artesunate가 세포질 부종 및 액포 형성, 미토콘드리아 해체, 핵 확장 및 세포 용해를 특징으로 하는 종양과 유사한 세포 사멸을 유도했다. 그러나 더 높은 용량에서 그들은 apoptosis를 유도하는 것으로 나타났다. [ 28 ].
=시험관 내에서 수행된 연구에서도 아르테미시닌이 리소좀과 미토콘드리아 내부에 축적되어 세포 사멸을 일으킬 수 있음을 발견했다.[ 29 , 30 , 31 ].
=아르테미시닌이 리소좀에 축적되고 리소좀 산성화와 단백질 분해를 일으키는 리소좀 액포형 H + -ATPase (V-ATPase) 의 조립을 촉진하여 세포 사멸을 초래한다는 것을 증명했다 .
=또한 아르테미시닌이 리소좀 단백질 분해를 향상시키고 독립적으로 자가 포식을 향상시킬 수 있다고 보고했다 [ 30 ].
=약물에 의해 억제되는 일부 증식 경로에는 Wnt /Beta 카테닌 경로, AMP 및 세포 내 신호 전달에 관여하는 두번째 메신저 NFκB, MYC, CREB 결합 단백질 (CREBBP), mTOR 및 혈관 신생 인자 . [ 16 ]
=아르테미시닌은 또한 사이클린 및 사이클린 의존성 키나제의 발현을 감소시키는 것으로 밝혀졌다. [ 32 ].
=아르테미시닌과 그 유도체가 세포 사멸과 괴사를 일으키는 다양한 분자 경로를 유도할 수 있다. [ 31 , 33 , 34 , 35 ].
=artemisinin, dihydroartemisinin 및 artemisone이 caspase-3 및 caspase-9를 포함하는 고유 경로를 통해 세포 사멸을 유도했다고 결론. [36 ].
=artemisinin이 in vitro에서 murin 비만 세포종 (P815) 세포에서 세포 사멸을 유도했다는 것을 증명했다 [ 37 ].
=시험관내 인간 위암 세포주에서 세포 사멸을 유도하는 artesunate 증명 [38].
=in vivo와 in vitro에서 인간 식도암 세포에서 아폽토시스를 유도하는 artesunate의 능력을 보고했다 [ 39 ].
=아르테미시닌이 Cdc42의 향상된 발현과 E-cadherin 단백질의 활성 증가를 통해 세포 간 부착을 증가시킴으로써 전이를 예방한다고 결론지었다 [ 40 ].
=다우노루비신과 디하이드로 아르테미신을 함유하는 옥트레오타이드 변형 리포솜이 유방암 세포에서 E-cadherin, α5β1-integrin, TGF-β1, VEGF 및 매트릭스 메탈로프로테이나아제-2/9 (MMP2 /9)의 조절을 통해 시험관 내 종양 세포 이동을 차단한다는 것을 입증했다. [ 16 ].
=가장 강력한 화합물은 디하이드로 아르테미시닌. [ 41 ]
암 치료제로서의 아르테미시닌
인간을 대상으로 여러 임상 시험이 수행되었다.
=국립 암 연구소 (National Cancer Institute)는 아르테수네이트를 사용한 체외 치료에 대한 반응을 평가하기 위해 55 개의 서로 다른 암 세포주를 대상으로 연구 수행. 이 연구에서 유방암, 전립선, 난소, 결장, 신장, 중추 신경계, 흑색종 세포를 포함한 여러 암세포가 화합물에 대한 감수성을 보여 주었다
미만성 거대 B 세포 림프종 세포를 대상으로 한 연구에서 artemether를 테스트
=artemether가 암세포의 증식을 억제하고 G0 /G1 단계에서 그들을 저지했으며 약물의 농도가 증가함에 따라 세포 사멸을 유도할 수 있다고 결론지었다.
=유사한 연구에서 artemisinin과 SM1044 유도체가 효과적으로 아폽토시스를 유도하고 미만성 거대 B 세포 림프종 세포에서 서바이빈 단백질을 분해한다는 것을 발견했다.
=합성 이량체인 2Py를 사용한 치료가 전립선암 세포주에서 서바이빈 단백질의 손실을 초래한다는 것을 발견했다 .
=SM1044를 사용하여 시험관 내에서 Kasumi-1 암세포를 치료했다. SM1044가 카스파제를 통해 세포 사멸을 유도하는 것을 관찰하고 세포 사멸률이 SM1044 농도에 정비례 한다고 결론지었다 .
=인간에 대한 보고된 임상 시험에는 아르테미시닌 유도체로 치료받은 유방암, 자궁 경부암, 간세포 암종, 비소 세포 폐암 및 편평 세포 후두암 환자가 포함됩니다 [ 49 , 50 , 51 ].
편평 세포 후두암 환자의 사례
=환자는 15일 동안 매일 60mg의 근육 내 artesunate 투여량에 이어 50mg의 경구용 artemisinin으로 9개월 동안 치료를 받았다.
=치료 2개월 후, 그들은 종양이 70 % 감소하고 환자의 연하 곤란 및 발성 장애가 급격히 개선되었다고 보고했다 [ 49 ].
121 명의 비소세포성 폐암 환자의 임상시험 연구.
=한 그룹은 시스플라틴으로 vinorelbine의 기존 치료를 받았으며, 두번째 그룹은 앞서 언급한 치료와 8일 동안 정맥 내 artesunate를 받았다.
=그들은 전통적인 치료를 받은 그룹 (72.7 %)에 비해 아르테미시닌과 함께 전통적인 치료를 받은 그룹 (88.2 %)에서 질병의 통제가 증가하는 것을 관찰했다 [ 50 ].
10 명의 여성에서 자궁 경부암에 대한 아르테니몰-R이라고도 하는 dihydroartemisinin의 효과를 연구
=치료 3주 후 대부분의 환자는 심각한 독성의 증거없이 질 분비물과 통증을 포함하여 자궁 경부암의 징후와 증상이 호전되었다.
=또한, 이들 환자는 표피 성장 인자 수용체 (EGFR) 및 Ki-67 종양 유전자의 발현을 감소시켰다.
=4주간의 치료를 마친 후 6개월 동안 6명의 환자만이 재발했고 2명은 사망.
=재발한 나머지 4명의 환자는 4주 동안 dihydroartemisinin을 기반으로 한 동일한 치료를 받았다.
=치료 완료 6개월 후 나머지 모든 환자는 관해 상태에 있었다 [ 51].
아르테미시닌과 시너지 작용제로 사용되는 유도체
약물의 항 종양 효과를 높이기 위해 일반적인 화학 요법을 아르테미시닌 또는 그 유도체와 결합하는 연구
=아르테미시닌과 부티르산을 결합하는 것이 Molt-4 세포에 대해 이 두 약물을 단독으로 사용하는 것보다 더 효과적이라는 것을 발견했다 (몰트-4 세포=사람 임파구성 백혈병 세포주) [52].
=dihydroartemisinin이 췌장암 치료에서 gemcitabine의 항 종양 활성에 시너지 효과를 일으킨다는 것을 증명했다.
=그들은 생체 내와 시험관 모두에서 암세포의 성장 억제가 4 배 향상되었고, 젬시타빈 단독보다는 두 약물을 모두 사용했을 때 세포 자멸사가 2 배 증가했음을 확인했다 [ 53 ].
=dihydroartemisinin이 뮤린 루이스 폐암 세포주에서 높은 시험관내 항암 활성을 나타냄을 보여 주었다.
=dihydroartemisinin과 cyclophosphamide를 병용했을 때 더 높은 수준의 전이와 종양 성장 억제를 달성했습니다 [ 54].
=다배체 골수종의 치료에 일반적으로 사용되는 artesunate와 lenalinomide의 조합이 배수체 세포주에서 항 종양 활성의 인상적인 향상을 가져 왔다는 것을 발견했다 . [ 55 ], [ 56 ]
=뮤린 비만 세포종 (P815) 세포에 대해 빈크리스틴과 아르테미시닌을 병용했을 때 시너지 효과를 관찰했다 [ 37 ].
=아르테미시닌은 내성 암세포를 화학 감작이라고 하는 민감한 암세포로 바꾸는 것으로 입증되었다 [6 ].
=artemisinin, artesunate 및 dihydroartemisinin이 독소루비신 및 피라루비신과 결합될 때 P-당 단백질 과발현 K562 / ADR 및 MRP1 과발현 GLC4 /ADR 세포주에 대한 세포 독성을 증가 시킨다는 것을 발견했다 [ 58 ].
=일부 아르테미시닌 유도체는 혈액 뇌 장벽에서 P-gp를 억제하여 뇌암 치료의 후보가 되는 것으로 나타났다 [ 59].
=artesunate가 DNA 이중 가닥 파손을 복구하는 단백질인 RAD51의 하향 조절을 통해 난소암 세포를 시스플라틴에 민감하게 하여 암세포의 클론 생성 형성을 억제한다고 보고했다 [ 60 ].
=간암 세포에서 p53 상태에 관계없이 아르테미시닌과 그 유도체가 강력한 화학 감작제임이 입증되었다. [ 61 ].
=아르테미시닌은 암세포의 내성에서 면제되지 않으며, 아르테미시닌 및 그 유도체에 대한 플라스모듐 내성은 점점 더 보편화 되는 반면에 암세포가 아르테미시닌 또는 그 유도체에 내성을 갖게 된다는 보고는 거의 없습니다. 아마도 약물의 많은 가능한 작용 방식 때문일것입니다. [ 62 , 63 ], [ 6 ].
=전이성 유방암 세포를 대상으로 실시한 연구에서 전사 인자 NFκB와 활성 단백질 1 (AP-1)의 유도에 의해 내성이 발생했다고 보고했다 [64].
신장 질환에서 Artemisinin과 그 유도체의 치료 효과
www.frontiersin.org/articles/10.3389/fphar.2020.00380/full
=말라리아 치료에 하이드록시 클로로퀸 및 클로로퀸과 같은 다른 항 말라리아 약물보다 임상적으로 더 효과적입니다.
=아르테미시닌은 빠른 작용 시작을 가지며 경구투여 후 위장관에 빠르게 흡수될 수 있으며 반감기는 2 ~ 5 시간입니다.
=주로 간, 신장, 담즙에 분포하며 약물의 약 80 %가 투여 24 시간 이내에 소변과 대변을 통해 배설되었습니다 .
약리학적인 기능이 개선된 아르테미시닌 (ARS) 유도체
=artemether (ARM), artesunate (ART), β-aminoarteether maleate (SM934), dihydroartemisinin (DHA)
=ARM (2-4시간), ART (<1시간), DHA (~1시간)의 반감기는 더 짧고 경구 섭취는 비교적 안전한 경로를 나타냅니다.
=ARS의 항 염증 효과를 보면 NF-κB, TLR, STAT 및 PI3K / 단백질 키나제 B (AKT)활성 ,
=이는 면역-염증 반응을 매개하는 핵심 요소이며 신장 질환 진행과 관련이 있습니다.
=ARS 계열 약물이 주로 병원성 면역 세포의 활성화를 억제함으로써 면역 억제 기능을 수행할 수 있고 자가 면역 질환에 대한 조절 효과가 있다.
=ARS는 단백뇨를 개선하고 NS의 진행을 억제, 사구체 여과율을 감소시키고 신장 혈류를 증가시킴.
Artesunate 및 Sorafenib : 간암 세포 성장의 조합 억제
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6781774/
=멀티 키나제 억제제인 소라페닙 (Sora)은 전체 생존율 (OS) 개선에 상당한 효과를 나타내지만 종양 진행을 지연시킬 뿐입니다 .
=Sora를 넘어선 1차 치료 또는 Sora와 다른 표적 제제를 결합하려는 시도는 지금까지 성공적이지 않았습니다 .
=소라페닙과 아르테수네이트의 병용은 단일 약물 치료에 비해 세포 성장 억제를 크게 증가 시켰음을 보여주었다.
=이 효과가 현저해진 시작 농도는 HepG2의 경우 25μM에서 Art와 결합된 Sora의 경우 2.5μM, 125μM의 경우 2.5μM Sora였습니다. Art for Huh7 (그림 2).
=간암 세포 성장 억제에 대한 소라페닙과 아르테수네이트의 시너지 효과가 나타났습니다.
=Sora와 Art의 조합은 세포 사멸을 크게 증가시키며 세포 이동을 크게 줄입니다.
=병용 치료는 Sora 또는 Art 단독보다 VEGFR2 단백질 발현을 더 감소 시켰으며, 이는 이 두 약물이 협력적으로 항-혈관 형성 역할을 발휘함을 나타냅니다.
Pyronaridine의 항암 효과 (PYR)
onlinelibrary.wiley.com/doi/10.1002/bip.23398
몇몇 anilino-acridine 유도체는 항암 활성으로 잘 알려져 있습니다.
이 시리즈의 주요 화합물은 과거에 항 백혈병 약물로 사용되었던 항 종양 약물인 암사크린입니다.
암사크린은 DNA 삽입제이자 Topo2 효소의 강력한 억제제입니다.
퀴나크린은 또한 항암 특성을 나타내며 시스플라틴과 같은 다른 약물과의 시너지 작용으로 인해 항 종양제로서의 용도 변경이 제안되었습니다.
PYR은 또한 잠재적으로 유용한 항암제로 특성화 되었습니다.
PYR은 유출 P- 당 단백질 (P-gp)의 기능을 억제함으로써 MDR 암 세포주에서 다 약제 내성 (MDR) 표현형을 역전시키는 것으로 밝혀졌으며, 이에 따라 안트라 사이클린 약물의 세포 내 축적과 세포 독성 작용을 촉진합니다 .
인간 다제 내성 -1 (MDR-1, ABCB1) 유전자의 암호화된 산물인 P-gp를 억제하는 능력은 항 간질제와 같은 다른 화합물의 활성을 촉진하는데 활용될 수 있습니다.
PYR은 세포 독성 약물 (독소루비신)을 전달할 수 있는 나노 복합체에 포함되었으며 MDR 암 세포를 효과적으로 극복하기위한 화학 감작제로 PYR이 포함되어 있습니다.
또한, PYR은 화학 감작제일 뿐만 아니라 조직 기원이 다른 여러 암 세포주에 대해 직접적인 암 세포 사멸 활성을 나타내는 것으로 나타났습니다.
암세포 증식을 억제하고 세포 사멸을 유도하는 마이크로 몰 효능을 보였으며,이 활성은 DNA 결합력 및 DNA 삽입과 관련이 있었습니다.
72 시간 약물 치료 후 세포 증식을 50 % (CC 50 ) 감소시키는데 필요한 약물 농도는 세포 유형에 따라 1.5 ~ 9.4 μM 범위였습니다.
MDA-MB-231 유방암 세포와 HL-60 전 골수성 백혈병 세포는 각각 1.6 및 1.9 μM의 CC 50 값으로 약물에 매우 민감 했 으며 두 경우 모두 약물 유발 세포 자멸사의 명확한 증거가 제공되었습니다.
특히, PYR은 암세포에서 미토콘드리아 탈분극과 포스파티딜 세린 외부화를 유도하는 것으로 밝혀졌습니다.
PYR의 pro-apoptotic 활성과 암세포 성장을 억제하는 능력은 암 치료를 위한 약물의 잠재적인 사용을 재고하게 했습니다.
2018 년부터 미국 생명 공학인 Armaceutica Inc. (텍사스 엘파소)는 특정 유형의 암을 치료하기 위해 PYR을 기반으로 한 용도 변경 전략에 참여했지만 자세한 내용은 없습니다.
PYR의 항 종양 활성은 DNA에 삽입하고 Topo2를 억제하는 능력에서 기인합니다.
흥미롭게도 벤조-나프티리딘 삼환형 코어에 PYR과 동일한 클로로 및 메톡시 치환체를 갖는 9- 아미노-아자-아크리딘 유도체는 강력한 DNA 결합 Topo2 독으로 기능하고 암세포의 세포 사멸을 유도하는 것으로 밝혀졌습니다.
'암 치료 약물 > 클로로퀸, 아르테미시닌' 카테고리의 다른 글
| 아르테수네이트 , 아르테미시닌 관련 논문 요약 (0) | 2021.10.04 |
|---|---|
| 아르테미시닌 항암 임상시험과 사례보고서 (0) | 2021.10.04 |
| 아르테미시닌의 암에 대한 효과와 임상시험 (0) | 2021.05.18 |
| 아르테미시닌 2탄 (0) | 2021.03.17 |
| 항암제로서의 클로로퀸 및 하이드록시 클로로퀸 (0) | 2021.01.26 |