우리가 흔희 알고 있는 괴사라는 의미.
괴사= 썩어서 없어짐, 사멸을 의미하며 영어로는 necrosis.
Necroptosis 는 apoptosis와 necrosis가 합쳐진 새로운 세포사멸기전이며 우리말로 표현하자면 세포자멸괴사라는 표현이 적절할 것 같다.
세포자멸괴사(necroptosis)라는 용어는 2005년 Junying Yuan 박사와 동료들이 계획된 괴사에 대해 TNFα 유도 괴사가 수용체-상호작용 단백질 1(RIP1) 키나제 억제제인 necrostatin-1에 의해 억제된다는 것을 발견했을 때 만들어졌습니다.
necroptosis의 발견은 세포가 프로그램된 방식으로 괴사를 실행할 수 있고 apoptosis가 항상 선호되는 세포 사멸 형태는 아니라는 것을 보여주었다.
Necroptosis는 척추 동물에만 해당되며 병원체에 대한 추가 방어로 시작되었을 수 있다.
Necroptosis는 또한 apoptosis 신호 단백질이 바이러스에 의해 차단되는 바이러스 감염 동안과 같이 세포가 apoptosis를 겪을 수 없는 경우에 대안적인 "안전한" 세포 사멸 경로로 작용한다.
Necroptosis가 왜 중요한가요?
결과적인 괴사는 바이러스에 감염된 세포를 죽이고 숙주 세포에서 외부 환경으로 위험 신호를 방출함으로써 선천적 면역 반응을 유발하는데 필수적입니다.
또한 T 세포의 괴사는 항원 활성화 T 세포 증식과 생존을 조절합니다.
세포 자살은 유기체 전체에 병원체가 퍼지는 것을 막는 효과적인 수단이다.
감염에 대한 세포자멸사 반응에서 감염된 세포(병원체 포함)의 내용물은 식균작용에 의해 포함되고 삼켜진다 .
Necroptosis는 주로 TNF와 같은 신호에 의해 활성화되는데 일반적으로 caspase-8에 의해 RIP1과 RIP3의 cleavage가 일어남으로써 세포자멸괴사는 일어나지 않게 된다.
바이러스 감염등의 다양한 상황에서 caspase-8의 활성이 저해되었을 때 RIP1-RIP3으로 구성된 necrosome complex가 형성되어 necroptosis를 유도하게 된다.
Necroptosis를 수행하는 신호 전달 경로
TNFα 가 수용체인 TNFR1을 자극합니다.
TRADD (TNFR1 결합 단백질 TNFR 관련 사멸 단백질) 및 TRAF2 (TNF 수용체 관련 인자 2)는 RIPK1에 신호를 보내 RIPK3을 모집하여 리폽토솜(ripoptosome)이라고도 하는 괴사를 형성합니다.
리폽토솜에 의한 MLKL의 인산화는 MLKL의 올리고머화를 유도하여 MLKL이 원형질막 및 세포 소기관에 삽입되고 투과되도록 합니다.
MLKL의 통합은 염증성 표현형 및 손상 관련 분자 패턴(DAMP)의 방출로 이어집니다., 면역 반응을 유도합니다.
TNF 괴사 신호전달 메커니즘

Necroptosis는 카스파제에 독립적인 방식으로 조절된 괴사 세포 사멸 양식이며 주로 수용체-상호작용 단백질 1(RIP1), RIP3 및 혼합 계통 키나제 도메인-유사(MLKL)에 의해 매개됩니다.
Necroptosis는 apoptosis 저항을 극복하는 프로그램된 세포 죽음의 대체 모드 역할을 하며 암 치료에서 항종양 면역을 유발하고 증폭할 수 있습니다.
Necroptosis는 바이러스 감염 및 발달에 중요한 역할을 하는 것 외에도 종양 발생, 암 전이, 암 면역 및 암 하위 유형을 포함한 암 생물학의 조절에서 중추적인 역할을 하는 것으로 제안되었습니다.
즉 necroptosis를 유도하거나 조작하여 암을 방어하는 화합물과 여러 치료제가 있을 수 있습니다.
necroptosis, apoptosis 및 autophagy 간의 상호 작용
대부분의 설정에서 apoptosis는 기본 세포 사멸 방식인 반면, necroptotic pathway는 일반적으로 주요 apoptotic mediator가 약리학적 억제나 유전적 절제에 의해 차단되거나 스트레스를 받은 세포가 세포 자멸을 겪을 수 없는 경우 발생하는 "fail-safe" 세포 사멸 기구로 간주됩니다.
그러나 백시니아 바이러스[ 40 ] 와 같은 특정 바이러스 감염의 맥락에서 또는 시코닌과 같은 특정 화합물에 의해 유도될 때 [ 41], necroptosis가 세포 소멸 모드로 우세할 수 있습니다.
또한 연구에 따르면 세포 내 아데노신 삼인산(ATP) 수치가 다음과 같이 세포 사멸 결정을 전환할 수 있다고 밝혔습니다.
ATP 고갈은 세포 사멸을 방지하고 괴사를 유도하며, ATP 고갈 T 세포의 포도당 보충은 세포 사멸 경로를 세포 사멸로 전환하기 때문에 apoptosis는 주로 caspase 활성화 및 apoptosome 형성과 같은 ATP를 필요로 하는 단계를 포함하는 고도로 에너지 소모적인 과정입니다.
따라서 세포의 에너지 상태는 세포 사멸 양식에도 영향을 줄 수 있습니다.
오토파지는 리소좀 내의 세포질 단백질과 소기관을 분해하여 기아, 세포 및 조직 개조, 세포 사망 등 다양한 스트레스 하에서 영양분과 에너지를 공급하는 "자체 섭취" 과정이며 또한 세포 에너지 가용성에 의해 조절된다.
보고에 따르면 Autophagy는 에너지를 회복하여 ATP가 고갈된 세포를 necrosis/necroptosis로부터 구하고, autophagy의 억제는 대사 위기를 초래하고 necroptosis를 촉진할 수 있습니다 .
Necroptosis는 autophagy를 촉진하는 것으로 보고되었습니다.
예를 들어, necroptosis 동안 생성된 높은 수준의 활성 산소종(ROS)은 손상된 세포기관과 단백질을 분해하는 자가포식을 유도할 수 있습니다.
또한, RIPK1은 necroptosis와 무관한 autophagic 신호의 조절에 중요한 역할을 하는 것으로 제안되었습니다[ 48 ].
유사하게, 대부분의 경우 autophagy는 apoptosis의 시작을 억제하고 apoptotic pathway에서 caspase의 활성화는 주요 pro-autophagic mediators의 절단으로 이어진다[ 49 ].
어떤 경우에 autophagy는 내인성 apoptosis 억제제를 제거하거나 autophagosome 형성을 통해 capsapse-8 활성화를 위한 플랫폼을 만들어 apoptosis를 촉진할 수도 있습니다[ 49 ].
Map3k7 결실의 배경에서 autophagic 경로는 RIPK1의 p62 의존적 모집에 의해 매개되는 necrosome이 보다 효율적으로 활성화 되도록 하는 스캐폴드 역할을 하여 세포 사멸 모드를 apoptosis에서 necroptosis로 전환할 수 있음을 보여주었습니다. [ 50].
메커니즘이 차단되면 세포는 세포 사멸을 통해 죽을 수 있습니다 [ 50 ].
분명히, apoptosis, necroptosis 및 autophagy 사이의 상호 작용은 매우 복잡하고 추가 조사가 필요합니다.
암에서 necroptosis의 관련성
Necroptosis는 암의 친구이자 적.
종양 성장을 촉진하고 감소시키는 이중 효과.
Necroptosis는 종양 발달을 예방할 수 있지만 괴사 세포 사멸 방식으로서 괴사는 염증 반응을 유발할 수 있고, 보고에 따르면 암 전이와 면역 억제를 촉진합니다[ 63 , 64 ].
RIPK3 발현은 수많은 암세포주에서 존재하지 않거나 감소합니다.
특히, RIPK3 단백질 발현의 손실은 테스트한 60개 이상의 암세포주 중 2/3에서 발견되었습니다.
100명 이상의 환자를 대상으로 한 코호트 연구에서 낮은 RIPK3 발현은 독립적으로 감소된 DFS(무병 생존) 및 OS(전체 생존)를 예측하는 것으로 밝혀졌습니다.
더욱이, RIPK3가 없는 마우스는 결장직장암이 발병할 위험이 더 높고 더 많은 수의 전염증성 또는 종양 촉진 인자를 생성하는 것으로 보고되었습니다 .
유사하게, 낮은 RIPK3 발현은 유방암 환자에서 더 나쁜 예후를 나타냅니다.
게놈 메틸화 및/또는 저산소증이 많은 암 세포주에서 RIPK3 발현을 억제하는데 중추적인 역할을 할 수 있습니다.
종합적으로, 이러한 연구는 암에서 괴사 경로의 항종양 역할을 암시합니다.
그러나 괴사 인자의 하향 조절은 모든 암에서 발생하는 것으로 보이지는 않습니다.
necroptotic factor의 발현은 일부 암에서 상향조절되는 것으로 밝혀졌습니다.
예를 들어, 교모세포종에서 RIPK1은 일반적으로 과발현되고 RIPK1 발현의 상향 조절은 더 나쁜 예후와 상관관계가 있습니다.
유사하게, RIPK1 발현은 인간 폐암 샘플과 마우스 폐 종양 모델 모두에서 현저하게 증가되었으며, RIPK1은 발암성 역할을 하는 것으로 제안되었습니다.
특히, RIPK1, RIPK3, FADD 및 MLKL의 발현은 가속화된 종양 형성을 동반하는 췌관 선암종(PDA)에서 증가합니다.
암에서 necroptotic 요인의 발현과 암 예후에 미치는 영향
| 암 유형 | 괴사인자의 발현 | 예후에 미치는 영향 | 참고 |
| 유방암 | RIPK3 발현 감소 | 더 나쁜 예후 | [ 7 , 65 ] |
| 대장암 | RIPK3 발현 감소; MLKL 발현 감소 | 감소된 DFS 및 OS; OS 축소 | [ 12 , 66 , 67 ] |
| 급성 골수성 백혈병 | RIPK3 발현 감소 | 가속화된 백혈구 생성 및 더 나쁜 생존 | [ 11 , 68 ] |
| 흑색종 | RIPK3 발현 감소; CYLD 발현 감소 |
언급되지 않은; 향상된 종양 진행 및 전이 | [ 69 , 70 ] |
| 두경부 편평세포암 | RIPK1 발현 감소 | 강화된 종양 형성 | [ 9 ] |
| 만성 림프구성 백혈병 | CYLD 발현 감소 | OS 축소 | [ 71 ] |
| 교모세포종 | RIPK1 발현 증가 | 더 나쁜 예후 | [ 10 ] |
| 폐암 | RIPK1 발현 증가 | 촉진된 종양 형성 | [ 72 ] |
| 췌장암 | RIPK1, RIPK3, FADD 및 MLKL의 발현 증가 | 촉진된 종양 형성 | [ 64 , 73 ] |
| 위암 | MLKL 발현 감소 | OS 축소 | [ 74 ] |
| 난소암 | MLKL 발현 감소 | OS 축소 | [ 75 ] |
| 자궁경부 편평세포암 | MLKL 발현 감소 | OS 축소 | [ 76 ] |
OS : 전체 생존
Necroptosis 및 암 면역 감시
암의 면역 감시는 종양 특이적 항원(TSA, tumor-specific antigen) 또는 종양 관련 항원(TAA)을 기반으로 우리 몸에 위협이 되기 전에 면역 체계가 암성 및/또는 전암성 세포를 식별하고 제거하는 과정을 말합니다.
이 과정은 수지상 세포(DC, dendritic cells), 세포독성 T 세포, M1 대식세포, 자연 살해(NK) 세포, 자연 살해 T(NKT) 세포 및 이에 상응하는 사이토카인을 포함한 선천적 및 적응 면역 세포 및 효과기 분자에 의해 매개됩니다.
RIPK3은 조절성 사이토카인을 발현하고 선천 면역계와 후천성 면역 시스템을 연결함으로써 면역 항상성을 조절하는 중요한 감시인 수지상 세포에서 사이토카인 발현의 조절에 필요한 것으로 밝혀졌습니다[ 83 ].
또한, RIPK3 신호전달이 T 림프구, B 림프구 및 대식세포의 활성화 조절에 역할을 하지 않을 수 있다는 증거에도 불구하고, RIPK3은 necroptosis pathway와 무관한 과정을 통해 mitochondrial phosphatase phosphoglycerate mutase 5(PGAM5)를 활성화하여 NKT 세포 기능을 조절하고 NKT 세포 매개 항종양 면역 반응을 촉진하는 것으로 제안되었다.
또한, 중앙 관용(central tolerance)을 유지하는데 있어 세포자멸사의 기능은 잘 정의되어 있지만, 몇몇 보고서들은 necroptosis는 주로 과도한 T 세포의 제거를 통해 T 세포의 항원 유도 증식에서 조절 역할을 한다고 밝혔습니다.
자극에 의해 활성화될 때 말초 T 세포의 항상성과 T 세포의 생존을 유지하고 괴사 의존적 과정은 카스파제-8에 의해 부정적으로 조절됩니다.
Necroptosis는 T 세포 증식의 후기 단계에서 발생하며 FADD가 없는 T 세포에서 괴사 신호가 현저하게 강화되어 FADD가 T 세포 수용체에 의해 매개되는 괴사를 부정적으로 조절할 수 있음을 시사합니다[ 87 ].
FADD : FAS-associated death domain protein
DAMP : Damage-associated molecular pattern
면역 세포와의 직접적인 상호 작용 외에도 necroptosis는 DAMP를 조직 미세 환경으로 방출하여 적응 면역 반응을 시작하고 necroptotic 세포가 식균된 후 수지상 세포 및 대식세포와 같은 식세포는 전 염증성 사이토카인을 방출하여 자극 분자를 증가시키고 교차 제시를 증폭시켜 강한 면역 반응을 유발합니다. [ 36 , 88 ].
Necroptotic 세포는 세포독성 CD8+ T 림프구를 활성화하는 항원 교차 프라이밍을 위해 DC에 항원과 염증성 사이토카인을 모두 제공할 수 있습니다[ 89 , 90 , 91].
프로그램된 세포 사멸 동안 RIPK1 발현과 NF-κB 활성화가 CD8+ T 세포 적응 면역을 시작하는데 필수적이며 necroptotic 세포가 유발하는 면역 반응에 의해 활성화된 CD8+ T 세포가 다양한 이펙터 사이토카인을 방출하여 생체 내 세포 용해 효과를 입증하고 종양 형성에 대해 마우스를 방어한다는 것을 입증했습니다. [ 89 ].
흑색종의 치료를 위해 괴사를 유도하는 것으로 입증된 범-카스파제 억제제 zVAD-fmk와 방사선 요법, 화학 요법 및 온열 요법을 포함한 기타 치료법의 사용은 조절 T 세포(Treg)의 종양 침윤을 감소시키고 종양 미세 환경에서 DC 및 CD8+ T 세포 침윤을 증가시켜 종양 성장을 현저히 감소시켰습니다. [ 24].
Schmidt 등은 자궁경부암 세포에서 괴사를 유발하는 바이러스 dsRNA 유사체인 PolyI:C에 의해 유도된 괴사성 자궁경부암 세포가 인터루킨-1α(IL-1α)를 생성하며, 이는 수지상세포가 항종양 효과에 중추적인 사이토카인인 IL-12를 방출하도록 활성화하는데 필수적입니다.
그리고 자궁경부암 세포에서 RIPK3의 발현 수준은 PolyI:C-유도 면역 요법의 효능을 예측할 수 있습니다.
따라서 면역치료는 RIPK3 수준에 따라 맞춤화 되어야 합니다.
암 면역의 유도 및 증폭에서 necroptosis의 역할에도 불구하고 necrosis/necroptosis에 의해 모집된 면역 염증 세포가 혈관 신생을 촉진하고 암세포 증식을 촉진하며 암 전이를 가속화함으로써 종양 발달을 촉진할 수 있다는 여러 증거가 있습니다 [ 1 , 93 ].
또한 괴사/괴사 세포는 IL-1α와 같은 조절 사이토카인을 방출할 수 있으며, 이는 인접 세포의 증식을 직접 자극하고 잠재적으로 신생물 진행을 촉진할 수 있습니다.
활성화된 염증 세포는 또한 반응성 질소 중간체(RNI)와 ROS를 방출하여 DNA를 손상시키고 게놈 불안정을 일으켜 종양 형성을 촉진할 수 있습니다[ 93]
조직 미세 환경으로 DAMP의 방출을 통해 괴사성 종양 세포는 항원 교차 프라이밍을 위해 수지상세포에 항원과 염증성 사이토카인을 모두 제공하여 세포독성 CD8+ T 림프구를 활성화시켜 종양 세포를 제거할 수 있습니다.
그러나 necroptotic 세포에 의해 방출된 DAMP는 면역 염증 세포를 모집하고 염증을 유발할 수 있으며, 이는 혈관신생을 촉진하고 암세포 증식을 촉진하며 암 전이를 가속화함으로써 종양 발달을 촉진할 수 있습니다.
또한 프로그램된 세포 사멸 동안 RIPK1 발현과 NF-κB 활성화는 CD8+ T 세포 적응 면역을 시작하는데 필수적입니다.
Necroptosis는 또한 췌관선암(PDA)에서 생체 내 면역억제성 종양 미세 환경을 생성하여 췌장암의 종양 발생을 촉진하는 것으로 나타났습니다[ 64 ].
necroptosis의 차단은 T 세포를 확장하고 활성화할 수 있는데, 이는 췌장암에서 체크포인트 기반 면역치료제의 불만족스러운 효능을 개선하기 위한 유망한 방법입니다[ 64 ].
암 면역에서 necroptosis의 역할
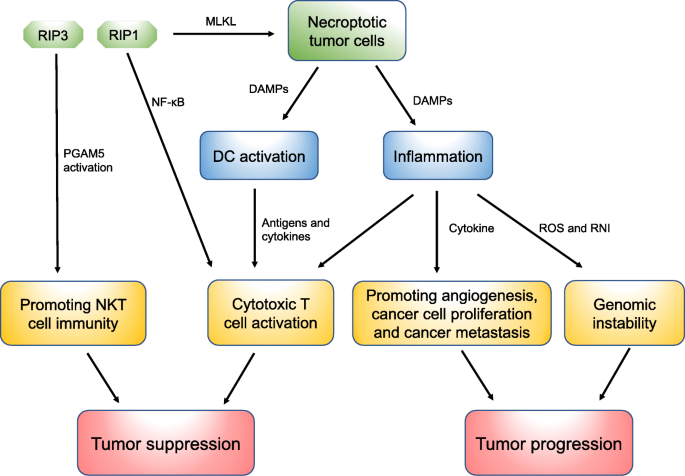
종양 진행을 촉진하는 necroptosis의 메커니즘과 암 전이에서 necroptosis의 역할
necroptosis 경로는 암에서 양날의 검
Liu 등은 여러 유방암 세포주에서 암 세포에서 RIPK1, RIPK3 또는 MLKL 유전자의 녹아웃이 종양 형성을 현저하게 감소시키고 유방암 세포를 방사선 요법에 민감하게 만드는 것으로 나타났음을 입증했습니다.
더욱이, 이종이식 모델에서 괴사 억제제 NSA(necrosulfonamide)는 종양 성장을 크게 지연시켰습니다[ 17 ].
또한, 저자는 MLKL의 더 높은 인산화 수준이 결장암 및 식도암 환자의 더 나쁜 예후 및 더 짧은 생존과 상관관계가 있다고 보고했으며, 이는 necroptotic 유전자가 종양 촉진에 중요한 역할을 한다는 것을 나타냅니다[ 17 ].
또한 Seifert 등은 RIPK3 또는 RIPK1의 생체 내 결실이 마우스에서 종양 진행 및 면역 억제를 약화시켰다고 보고하고 케모카인 유인물질인 CXCL1(케모카인(CXC 모티브) 리간드 1) 및 necroptosis에 의해 유도된 Mincle 신호는 골수 세포에 의한 적응 면역 억제의 유도를 촉진합니다. [ 64]
종합적으로, 이러한 연구는 괴사 경로가 종양 진행의 위험을 증가시킬 수 있음을 나타냅니다.
이 겉으로 보기에 역설적인 현상의 근간이 되는 메커니즘은 괴사에 의해 유발된 염증 반응과 관련이 있을 수 있으며, 이는 종양을 촉진하는 염증성 미세 환경 또는 증가된 활성 산소종(ROS) 생성을 제공할 수 있으며, 이는 게놈 불안정성과 상관 관계가 있습니다[ 97], 궁극적으로 악성 변형 및 암 진행을 가속화 합니다 [ 98 , 99 ].
전이는 암 환자에서 사망에 이르는 주요 원인이며 순환계를 통해 원발 부위에서 먼 장기로 암세포가 전파되는 것을 포함합니다.
전이에서 necroptosis의 역할도 이중성을 나타냅니다.
Fu 등은 in vivo 골육종 모델에서 한약에서 사용되는 성분인 shikonin에 의해 RIPK1 및 RIPK3 의존성 괴사를 유도하여 원발성 종양뿐만 아니라 폐 전이도 현저히 감소했다고 보고했습니다[ 100 ].
necroptosis의 항전이 역할의 기초가 되는 한 가지 가능한 메커니즘은 세포외 기질(ECM) 분리 및 대사, 그리고 궁극적으로 암 전이에서 괴사를 포함하는 ROS 생성 조절에서의 기능일 수 있습니다[ 101 ].
실제로, RIPK3은 다운스트림 ROS의 생성을 조절하는 것으로 입증되었으며, ROS의 상당한 생산을 공동으로 유도하는 괴사 과정에서 TNF 유도 ROS 생성을 조절하기 위해 여러 대사 효소를 활성화할 수 있습니다. [ 101 , 102] [ 51 ]
그래서 ROS bursts를 유발하여 necroptosis가 전이성 암세포를 죽일 수 있습니다.
따라서 괴사는 종양 전이를 억제하는 중요한 경로일 수 있습니다.
그러나 대조되는 증거에 따르면 특정 상황에서 괴사가 암세포 전이를 촉진할 수 있습니다.
종양 세포가 혈관에서 빠져 나와 이차 부위로 들어가는 과정인 혈관외 유출은 전이의 중요한 단계입니다.
Strilic 등은 종양 세포가 DR6(사멸 수용체 6)의 활성화를 통해 종양 세포 유출 및 암 전이를 촉진하기 위해 괴사 내피 세포 사멸을 유도할 수 있다고 보고했습니다. [ 63].
그 연구는 종양 세포와 공동 배양할 때 내피 세포가 괴사 세포 사멸을 겪는다는 것을 보여주었습니다.
유사하게, 전이성 종양 세포로 치료한 후, 쥐의 폐 상피 세포는 괴사 특징을 보였다.
더욱이, DR6의 리간드 APP(아밀로이드 전구체 단백질)에 대한 결합은 내피 세포 사멸 및 암 세포 유출을 촉진했습니다.
Strilic 등은 괴사된 내피 세포는 종양 세포가 통과하여 혈관외 유출을 시작할 수 있는 터널을 제공하고 괴사 세포에 의해 생성된 DAMP(손상 관련 분자 패턴) 분자는 종양 세포 및 인접 내피 세포에 영향을 미치며 암세포의 유출과 전이를 촉진한다고 설명합니다.
따라서 저자는 DR6 매개 내피 세포 괴사를 표적으로 하는 치료법이 암 전이를 예방하기 위한 새로운 접근 방식을 나타낼 수 있다고 제안했습니다.
따라서, 요약하면, 괴사의 특정 역할이 보편적이지 않을 수 있고 각 암 유형의 다양한 생물학적 특성 또는 종양 미세 환경에 따라 다를 수 있기 때문에 종양 발생 및 암 전이에 대한 괴사(necroptosis)의 순 효과는 정의되지 않은 채로 남아 있습니다.
necroptosis가 종양 성장 및 전이를 촉진하거나 억제하는지 여부는 결정적으로 결정할 수 없습니다.
암 치료에서의 괴사
항암 요법에서 necroptosis를 유도 및 조작하는 것은 apoptosis-resistant 암세포를 제거하는 대안적인 방법으로 작용할수 있습니다.
여러 많은 화합물 및 화학요법제가 암세포에서 괴사를 유발하는 것으로 보고 되었습니다(표 3 ).
암 치료에서 괴사를 유도하는 화합물
| 화합물 및 제제 | 특징과 Necroptosis 유도의 메커니즘 | 암 유형 | 참고 | |
| 시코닌(Shikonin) | 나프토퀴논, 지치(Lithospermum erythrorhizon)의 말린 뿌리. ROS 생산; RIPK1/RIPK3 괴사체 형성 |
백혈병; 골육종; 췌장암; 신경교종 |
[ 100 , 104 , 103 , 105 ] | |
| 스타우로스포린 | 항암 활성을 나타내는Streptomyces staurosporeus 에서 분리된 세포 투과성 알칼로이드, 천연항생제. 세포자멸사를 유도하는 단백질 키나제 억제제. RIPK1/MLKL 종속 |
백혈병 | [ 106 , 107 ] | |
| 네오알바코놀 | 다발방패버섯(Albatrellus confluens) 추출물, TNFα의 자가분비 분비; 세포 에너지 대사 리모델링 |
비인두암 | [ 108 , 109 ] | |
| 레시부포게닌 | 두꺼비에서 추출한 독소. 부파디에놀리드 RIPK3 및 MLKL 단백질 상향 조절 |
대장암 | [ 110 ] | |
| 방사선 요법 | 방사능 카스파제-8 활성화 억제 |
갑상선 암; 부신피질암; 결장직장암 세포; 교모세포종 | [ 111 ] | |
| 5-FU | 화학요법제 TNF-α 생산; RIPK1 활성화 |
대장암 | [ 114 ] | |
| B12536 | 강력한 폴로-유사 키나제(Polo-like kinase 1, Plk1)억제제 유사 분열 재앙. 유나이티드제약, 표적항암제 PLK1억제제 물질특허 등록(2018.) |
전립선암 | [ 115 ] | |
| Compound C | AMP 활성화 단백질 키나제 억제제, 도르소모르핀. 칼페인/카텝신 매개 |
신경교종 | [ 116 ] | |
| 소라페닙 | 멀티키나제 억제제 ROS 생산; RIPK1 활성화 |
다발성 골수종; 호지킨 림프종 | [ 117 ] | |
| 오로라 키나제 A 억제제 | 오로라 키나제 억제제 괴사 활성화 촉진 |
췌장암 | [ 120 ] | |
| TRAIL(TNF-related apoptosis-inducing ligand) | 세포사멸(apoptosis)을 유도하는 리간드 역할을 하는 단백질. 사이토카인. TNFR1 신호전달; RIPK1/RIPK3 의존, ROS 생산 |
대장 암; 간 암; 췌장암 | [ 121 , 122 ] | |
| CD95L | 사멸 수용체 리간드 CD95 신호전달; cIAP의 규제 |
췌장암 | [ 123 ] | |
| 종양 용해성 바이러스 | 바이러스 면역원성 분자의 노출 |
신경교종; 난소 암 | [ 124 ] | |
| 혈구응집 바이러스 | 바이러스 칼슘 칼모듈린 키나제 II 의존성 |
신경 모세포종 | [ 127 ] | |
| 은 나노 입자 | 금속 나노 입자 RIPK1/RIPK3/MLKL 종속 |
췌장암 | [ 128 ] | |
| 셀레늄 나노입자 | 금속 나노 입자 RIPK1 종속 |
전립선암 | [ 131 ] | |
| 스맥 모방체 | IAP 길항제, 암 세포 사멸을 유도하고 암세포에서 생존 신호 전달을 차단 ROS 생산; cIAP 억제; TNFα 의존성 |
백혈병; 췌장암 | [ 132 ] | |
| MG132 및 보르테조밉 | 프로테아좀 억제제 RHIM 종속 |
백혈병 | [ 135 ] | |
| 오바토클락스 | Bcl-2 억제제 autophagosomes의 Atg5 의존성 괴사체 조립 |
횡문근육종; 모두 | [ 136 ] | |
| 폴리아이:씨 | 바이러스 dsRNA 유사체 RIPK3 의존성; TLR3/TLR4 활성화 |
자궁 경부암; 대장 암 | [ 92 ] | |
| ZZW-115 | NUPR1 억제제 미토콘드리아 대사 파열 유도 |
췌장암 | [ 137 ] | |
Necroptosis는 autophagy 및 apoptosis와 복잡한 상호 작용에 관여하는 강력한 면역원성을 가진 괴사 프로그램된 세포 사멸입니다.
necroptosis는 암 환자의 예후, 암 진행 및 전이, 암 면역 감시 및 암 하위 유형에 중요한 역할을 합니다.
necroptosis 경로를 유도하거나 조작하는 다양한 약물, 화합물 및 제제를 통한 necroptosis의 표적화는 암 치료에서 세포자멸사 저항성을 우회하고 항종양 면역을 지원하기 위한 새로운 접근 방식으로 등장했습니다.
necroptotic pathway에서 주요 단백질 발현의 일반적인 하향 조절은 암세포가 생존을 위해 necroptosis를 피할 수도 있음을 시사했습니다.
그러나 PDA와 같은 일부 유형의 암에서는 핵심 매개체의 발현 수준이 상승된 것으로 나타났습니다.
Necroptosis는 DC를 활성화하고 항종양 면역을 강화하는 다양한 면역 조절 사이토카인과 DAMP의 방출을 통해 강력한 면역 반응을 유도할 수 있습니다.
그러나 모집된 염증 세포는 혈관 신생 및 암 침습성을 촉진하고 면역 억제 종양 미세 환경을 생성할 수 있습니다.
Necroptosis는 또한 암에서 항전이 역할의 증거에도 불구하고 발암 및 암 전이를 촉진하는 것으로 보고되었습니다.
또한 necroptosis는 특정 암의 암 하위 유형을 결정하기 위해 계보 헌신을 지시할 수 있습니다.
과다한 화합물 및 제제가 괴사를 유발하거나 조작하고 유망한 항종양 효능을 나타내는 것으로 밝혀졌습니다.
그러나 괴사를 표적으로 하는 치료제를 조사하는 대부분의 연구는 시험관 내 실험 및/또는 동물 모델을 기반으로 하므로 이러한 화합물 및 항암제의 임상 사용 가능성은 여전히 생체 내 및 임상 시험에서 평가되어야 합니다.
또한 necroptosis-targeting 치료제의 표적외 효과를 면밀히 조사해야 하며, necroptosis 유도제와 종양 유도제를 결합하는 새로운 접근 방식을 개발하여 안전성과 선택성을 향상시켜야 합니다.
따라서 이러한 화합물 및 항암제의 임상 사용 가능성은 여전히 생체 내 및 임상 시험에서 평가되어야 합니다.
결론적으로 암에서 necroptosis의 정확한 역할은 완전히 밝혀져야 합니다.
다양한 보고서가 necroptosis의 항종양 기능을 지지하지만, 증가하는 증거는 necroptosis가 또한 종양 진행 및 전이를 촉진한다는 것을 나타내며, 이는 암에서 necroptosis 경로의 특정 역할이 다양한 유형의 암에서 맥락화되어야 함을 시사합니다.
[참고]
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-019-1029-8
https://en.wikipedia.org/wiki/Necroptosis
[별첨]
Neoalbaconol은 EGFR 매개 VEGF 생성을 억제하여 혈관 신생 및 종양 성장을 억제합니다.
https://pubmed.ncbi.nlm.nih.gov/27996164/
네오알바코놀이 유방암 세포의 증식을 억제하고 세포자멸사를 유도할 수 있음을 입증.
네오알바코놀은 생체 내 유방암 이종이식 모델에서 종양 성장 및 종양 혈관신생을 억제했다.
종합하면, 이러한 결과는 네오알바코놀이 혈관 내피 세포에 대한 직접적인 억제 효과 및 암세포의 혈관신생 인자 감소를 통해 종양 혈관신생 및 성장을 억제할 수 있음을 나타냅니다.
'암에 관한 모든 것' 카테고리의 다른 글
| 약물 유발과 심실 부정맥 (0) | 2022.03.08 |
|---|---|
| 건강을 위한 기생충 제거 프로그램 관련 정보 (0) | 2022.03.01 |
| AMPK (0) | 2021.09.27 |
| Atavistic theraphy 엉터리일까? 새로운 가설일까? (0) | 2021.08.05 |
| 부작용 빈도와 관련된 단어의 의미 (0) | 2021.06.25 |