Ivermectin(IVM)은 잠재적인 신경독성을 유발할 수 있습니다.
이 연구는 인간 신경모세포종(SH-SY5Y) 세포에서 IVM의 세포독성과 기본 분자 메커니즘을 탐구합니다.
결과는 24시간 동안 IVM 처리(2.5-15μM)가 SH-SY5Y 세포에서 용량 의존적 세포 사멸을 유도할 수 있음을 보여줍니다.
대조군과 비교하여 IVM 처리는 ROS 생성, 미토콘드리아 기능 장애 및 세포 사멸을 유의하게 촉진했습니다.
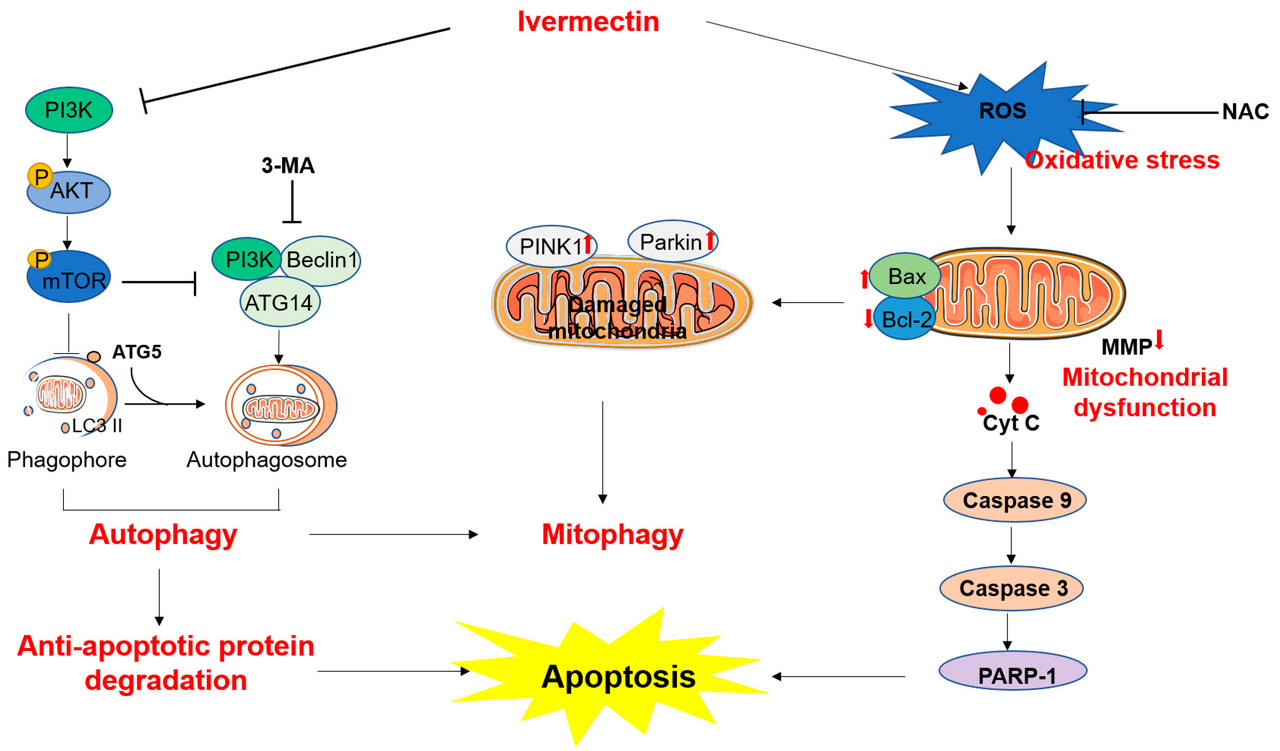
IVM 처리는 또한 인산화(p)-Akt 및 p-mTOR 단백질의 발현 감소, LC3II, Beclin1, ATG5, PINK 및 Pakin1 단백질의 발현 증가 및 자가포식소체 형성을 특징으로 하는 미토파지 및 자가포식을 촉진했습니다.
N-아세틸시스테인 처리는 SH-SY5Y 세포에서 IVM에 의해 유도된 ROS 생성과 세포 사멸을 유의하게 억제했습니다.
자가포식 억제제(예: 3-메틸아데닌) 치료는 IVM 유도 자가포식, 산화 스트레스 및 세포 사멸을 유의하게 억제했습니다.
종합하면, IVM이 ROS의 생성, 미토콘드리아 경로의 기능장애 및 Akt/mTOR 경로의 억제를 포함하는 SH-SY5Y 세포에서 자가포식 및 apoptotic 세포 사멸을 유도할 수 있음을 보여줍니다.
Autophagy 억제는 SH-SY5Y 세포에서 IVM 유발 산화 스트레스와 세포 사멸을 개선했습니다.
이 현재 연구는 IVM 유발 신경 독성의 분자 메커니즘을 이해하는데 새로운 통찰력을 제공하고 잠재적인 신경 보호제의 발견을 촉진합니다.
https://www.mdpi.com/2076-3921/11/5/908/htm
Ivermectin-Induced Apoptotic Cell Death in Human SH-SY5Y Cells Involves the Activation of Oxidative Stress and Mitochondrial Pat
Ivermectin (IVM) could cause potential neurotoxicity; however, the precise molecular mechanisms remain unclear. This study explores the cytotoxicity of IVM in human neuroblastoma (SH-SY5Y) cells and the underlying molecular mechanisms. The results show tha
www.mdpi.com
이버멕틴은 항암, 항염, 항당뇨병 및 항바이러스 효과를 포함한 여러가지 새로운 진통 효과를 나타냈습니다. [ 3 , 32 ].
특히 시험관 연구에서는 고용량의 이버멕틴이 Cov-2바이러스를 억제할수 있음을 보여주었습니다.
그러나 독성 효과때문에 임상에서 논란이 되고 있습니다.[ 3 , 33].
동물 실험에서 쥐에게 10 또는 15 mg/kg의 용량으로 IVM을 정맥 투여하면 중추 신경계(CNS) 우울증이 현저하게 나타날 수 있음이 나타났습니다[ 7].
불행히도, 현재까지 인간과 동물에서 IVM 유발 신경독성에 대한 치료 및 예방 전략은 매우 제한적입니다.
따라서 IVM에 의한 신경독성의 분자적 기전을 규명하는 것이 시급하다.
현재 연구에서 우리의 결과는 처음으로 2.5-15μM의 용량에서 24시간 동안 IVM 치료가 인간 SH-SY5Y 세포에서 현저한 세포 독성과 세포 사멸을 일으킬 수 있음을 보여줍니다.
또한, 우리 연구는 IVM에 의해 유도된 세포 사멸이 ROS, 산화 스트레스, 미토콘드리아 기능 장애, 자가포식 활성화 및 Akt/mTOR 경로의 생성을 포함한다는 것을 입증했습니다.
일반적으로 신경계는 산소 요구량과 고도 불포화 지방산 함량이 높으며 산화 손상에 매우 민감합니다[ 38 ].
많은 연구에서 산화 스트레스는 T-2 독소, 카드뮴 및 콜리스틴과 같은 다양한 환경 독소 또는 항생제 유발 신경 독성에서 중요한 역할을 한다고 보고했습니다.
일관되게 현재 연구에서 2.5-15μM에서 24시간 동안 IVM을 처리하면 인간 SH-SY5Y 세포에서 ROS, MDA 수준, SOD 및 CAT 활성 생성이 크게 증가했습니다.
MDA는 막 지질의 과산화에 대한 바이오마커입니다.
SOD와 CAT는 산화 스트레스에 반응하는 두 가지 중요한 내인성 항산화 효소입니다.
유사하게, Ogueji 등은 IVM이 MDA 수준의 상당한 증가와 Clarias gariepinus 에서 SOD 및 CAT의 활성으로 간 기능 장애를 유도함을 보여주었습니다. [ 43].
이전 연구는 항산화제 비타민 C가 쥐의 IVM으로 인한 신독성을 효과적으로 개선할 수 있음을 나타냈습니다[ 10 ].
현재 연구에서 항산화제 NAC 처리는 IVM에 의해 유도된 세포 ROS 생성과 세포 독성을 유의하게 억제했으며, 이는 과도한 ROS 생성이 IVM 유도 산화 스트레스, 지질 과산화 및 세포 사멸에 중요한 역할을 한다는 것을 나타냅니다.
IVM 치료는 또한 미토콘드리아 복합체 I의 활성을 유의하게 억제했습니다[ 36 ].
CI 및 II 결핍 세포가 미토콘드리아 ROS 생성 증가를 나타내는 것으로 입증되었습니다 [ 44 , 45].
이러한 증거는 기능 장애 미토콘드리아 복합체 I이 ROS 및 미토콘드리아 독성의 IVM 유도 생성에서 중요한 역할을 할 수 있음을 나타냅니다.
현재 연구에서 우리의 데이터는 IVM 처리가 ΔΨ m 의 손실을 유의하게 유도하고 인간 SH-SY5Y 세포에서 Bax/Bcl-2의 비율을 증가시킴을 보여주었습니다.
Bax/Bcl-2의 증가된 비율은 미토콘드리아 투과성 전이 기공의 개방을 유발할 수 있으며, 이는 붕괴된 ΔΨ m 과 함께 CytC 의 방출을 촉발하여 카스파제(예: 카스파제- 9 및 -3), 최종적으로 세포 사멸을 초래한다.
Caspase-3와 절단된 PARP-1은 두 가지 중요한 세포사멸 표지자입니다.
Caspase-9는 미토콘드리아 세포사멸 경로의 바이오마커입니다.
현재 연구에서 우리의 데이터는 IVM 처리가 절단된 카스파제-9, 절단된 카스파제-3 및 절단된 PARP-1 단백질 발현을 상당히 증가시킬 수 있음을 보여주었습니다.
종합하면, 이 증거는 미토콘드리아 세포사멸 경로가 IVM 유도 세포독성 및 신경독성에서 중요한 역할을 한다는 것을 나타냅니다.
본 연구에서는
(i). 자가포식소체 형성의 IVM 유도는 LC3II, Beclin1 및 ATG5의 면역검출에 의해 입증되었습니다.
LC3II 및 Beclin1은 자가포식의 마커이며 각각 자가포식 소포의 개시 및 폐쇄를 매개합니다.
ATG5는 자가포식소체 형성 및 확장을 조절하는 핵심 유전자입니다.
(ii). IVM 처리는 리소좀 산성화를 증가시켰습니다.
(iii). mRFP-GFP-LC3-형질감염된 SH-SY5Y 세포는 IVM 처리가 자가포식소체 및 자가용해소체의 형성을 증가시키고 자가포식 플럭스를 증가시키는 것으로 나타났다.
종합하면, 이 증거는 IVM 치료가 세포 자가포식 활성화를 촉진할 수 있음을 보여줍니다.
mTORC1은 산소, 아미노산 및 세포 에너지 수준과 같은 영양소에 반응하여 세포 성장 및 증식을 조절하는 조절 관련 복합체입니다.
mTORC1은 또한 자가포식을 조절하는데 중요한 역할을 합니다.
이는 ULK1/2-Atg13-FIP200 복합체와 직접 상호작용하고 ULK1 활성을 조절하고 자가포식을 제어할 수 있습니다.
따라서 mTOR의 상류 조절자로서 Akt는 일반적으로 자가포식 억제자로 간주됩니다.
차례로 Akt의 활성화는 PI3K를 포함하는 다단계 프로세스에 의해 제어됩니다.
PI3K/Akt/mTOR 경로는 콜리스틴, 메스암페타민, 알코올 및 비소와 같은 많은 신경증 약물 또는 독소 조절 자가포식 반응에 참여하는 것으로 입증되었습니다.
본 연구에서 우리의 결과는 IVM 치료가 PI3K와 그 두 가지 다운스트림 단백질인 p-Akt와 p-mTOR의 발현을 유의하게 하향조절한다는 것을 보여줍니다.
따라서 이러한 데이터는 인간 SH-SY5Y 세포에서 IVM 유도 자가포식이 Akt/mTOR 경로의 억제에 의해 조절됨을 나타냅니다.
autophagy와 apoptosis 사이의 누화는 많은 연구에서 언급되었습니다
Autophagy 활성화는 세포 사멸 과정에서 이중 역할을 할 수 있습니다.
이것은 약물 또는 세포 유형에 의해 결정됩니다
실제로, IVM 유도 자가포식 활성화는 인간 유방암 세포(즉, MCF-7 및 MDA-MB-231 세포), 신경교종 U251 및 C6 세포, HeLa 세포, SK-MEL-28 세포에서도 입증되었습니다.
흥미롭게도, 이 세포주에서 autophagy 활성화는 IVM에 의해 유도된 세포 사멸과 완전히 반대되는 기능을 나타냈습니다.
인간 SK-MEL-28, 신경교종 U251 및 C6 세포에서 자가포식을 억제하면 IVM에 의해 유도된 세포자멸사 세포 사멸이 향상되었습니다.
그러나 MCF-7, MDA-MB-231 및 HeLa 세포에서 자가포식의 억제는 IVM에 의한 세포자멸사 세포사를 유의하게 개선했습니다.
본 연구에서 우리는 자가포식소체의 형성을 차단하는 자가포식 억제제인 3-MA가 IVM 처리로 유도된 세포 생존율, 산화 스트레스, ΔΨm 손실 및 SH-SY5Y 세포의 세포자멸사를 상당히 약화시킨다는 것을 발견했습니다.
우리의 데이터는 IVM에 의한 자가포식 활성화가 인간 SH-SY5Y 세포에서 세포자멸사 세포사를 유발할 수 있음을 나타냅니다.
autophagy 매개 세포 사멸의 잠재적인 분자 메커니즘이 정의되었습니다.
즉, autophagy 유도는 apoptotic 신호를 시작하거나 apoptotic 단백질을 분해하여 세포 apoptosis를 촉진할 수 있습니다.
이전 연구에서는 ipomoea batatas 다당류가 Akt/mTOR 매개 자가포식 활성화와 항아포토시스 단백질인 Bcl-2의 자가포식 분해를 통해 폐암 세포에서 세포 사멸을 유도할 수 있음을 발견했습니다[ 57].
유사하게, 우리의 결과는 3-MA에 의한 자가포식 억제가 자가포식 단백질 LC3II, Beclin1 및 ATG5의 발현을 유의하게 억제하고 Bcl-2 단백질의 감소를 유의하게 차단한 다음 미토콘드리아 기능 장애 및 세포자멸사를 억제하기 위해 캐스케이드한다는 것을 보여줍니다.
종합하면, 이러한 데이터는 IVM에 의한 자가포식 활성화가 Bcl-2의 자가포식 분해를 촉발한 다음 인간 SH-SY5Y 세포에서 미토콘드리아 세포자멸 경로를 활성화할 수 있음을 나타냅니다.
특히 SH-SY5Y 세포와 신경교종 U251 및 C6 세포는 모두 종양 유래 신경 세포주에서 유래했지만 [ 17], IVM에 의해 유도된 자가포식 활성화는 이러한 서로 다른 세포주 사이에서 세포 운명에 반대 역할을 했습니다.
이 현상은 세포 운명 결정에서 IVM 유도 자가포식의 역할이 상황에 따라 다르다는 것을 나타냅니다.
그것은 또한 autophagy 억제제이고 다른 표적을 갖는 3-MA와 CQ의 차이점과 관련될 수 있습니다[ 17 ].
더욱이, 우리의 결과는 IVM 치료가 미토파지 과정에서 두 가지 중요한 바이오마커이자 기능적 단백질인 PINK1 과 Parkin 단백질의 발현을 유의하게 상향조절할 수 있음을 보여줍니다 [ 58].
미토파지는 선택적 자가포식이며 손상된 미토콘드리아를 제거하여 사망 신호의 활성화를 방지하는 역할을 합니다.
Mitophagy 활성화는 일반적으로 유해한 스트레스에 반응하여 세포에서 보호 역할을 합니다[ 59 ].
일관되게, Jia 등은 IVM 처리가 PINK1 및 Parkin 단백질의 발현을 상향 조절하고 쥐 H9c2 세포에서 미토파지를 활성화한다는 것을 발견했습니다[ 60 ].
이러한 데이터는 IVM 활성화 자가포식이 이중 역할을 할 수 있음을 나타내며, 이는 각각 미토파지 활성화 및 항세포자멸사 단백질 분해에 의존할 수 있습니다.
정확한 분자 메커니즘은 아직 더 많은 연구가 필요합니다.
결론
결론적으로, 우리의 결과는 IVM 처리가 활성산소종(ROS)의 생산을 상향조절할 수 있음을 보여줍니다.
과도한 ROS는 산화 스트레스와 미토콘드리아 세포 사멸 경로를 유발하여 결국 세포 사멸로 이어질 수 있습니다.
한편, IVM 처리는 PI3K/Akt/mTOR 경로의 발현을 하향 조절한 다음 자가포식소체의 형성과 자가포식의 활성화를 유도할 수 있습니다.
또한 PINK1 및 Parkin 단백질의 상향 조절을 통해 미토파지를 활성화할 수 있습니다.
또한, 3-MA는 SH-SY5Y 세포에서 자가포식을 차단하고 IVM 유발 산화 스트레스, 미토콘드리아 기능 장애 및 세포 사멸을 억제할 수 있습니다.
종합하면, 우리의 현재 연구는 IVM 신경 독성의 분자 메커니즘을 이해하는데 새로운 통찰력을 제공하고 잠재적인 신경 보호제의 발견을 촉진합니다.
'암 치료 약물 > 이버멕틴' 카테고리의 다른 글
| 이버멕틴이 개의 유선종양을 억제하는지에 대한 연구(세포주기 진행과 WNT 신호 전달을 조절하여) (0) | 2022.08.29 |
|---|---|
| 이버멕틴의 항종양 효과 : 용량적 접근 , 다양한 기전, 혈장농도 5 μM = 경구 복용량 2 mg / kg (0) | 2022.08.10 |
| 이버멕틴이 알콜중독 치료에 이용될 수 있다 (0) | 2022.04.28 |
| Ivermectin, 대장암 세포 성장 억제에 새로운 응용 (0) | 2022.01.14 |
| 유방암 치료를 위한 이버멕틴의 사용 (0) | 2022.01.14 |