이버멕틴이 효과있는 각종 암에 관한 자료(아래 클릭)에 보면 유방암 부분에 [이버멕틴, 유방암치료, 면역체크포인트 봉쇄와 함께 시너지 효과를 준다]는 논문이 있습니다.
오늘은 이 부분을 좀 더 세밀히 설명해 보겠습니다.
https://blog.daum.net/health-life/17
(종합편) 이버멕틴이 효과 있는 각종 암에 관한 자료 (종합편)
유방암, 대장암, 난소암, 신경교종, 비인두암, 흑색종, 전립선암, 폐 암, 위 암, 간 암, 신장세포암종, 백혈병에 이버멕틴이 어떻게 작용하고 어떤 효과를 내는지를 하나씩 열거해 보기로 한다. 현
blog.daum.net
연구는 삼중음성 유방암에 촛점을 맞추었습니다.
삼중음성 유방암 TNBC.
면역관문억제제(ICI) 요법은 암을 치료하기 위해 환자의 면역 체계를 활용하는 혁신적인 접근방식입니다.
그러나 단일 약제로서의 체크포인트 억제제는 일부 환자 및 암 유형에서만 효과적입니다.
그들은 유방암에 거의 영향을 미치지 않았습니다.
면역항암제, 즉 면역체크포인트억제제에 대한 설명은 아래를 참고하시기 바랍니다.
https://blog.daum.net/health-life/42
면역 체크포인트 억제제
면역항암제는 암 자체를 공격하는 기존 항암제와는 다르게 우리 몸의 면역체계를 자극해서 면역세포가 암세포를 공격하도록 유도하는 암 치료제입니다. 면역항암제는 면역관문억제제(immune chec
blog.daum.net
최근 연구를 보면 체크포인트 억제제의 효능은 주로 "뜨거운" 종양이라고 하는 T 세포가 이미 침투한 암에 국한됩니다.
대조적으로, "차가운" 종양은 T 세포 침윤이 거의 또는 전혀 없으며 일반적으로 ICI 요법에 반응하지 않습니다.
따라서 유방 종양을 프라이밍("차가운" 종양을 "뜨거움"으로 전환)하여 체크포인트 차단과 시너지 효과를 낼 수 있는 약물을 식별할 필요가 상당히 있습니다.
면역원성 세포 사멸(ICD)이라고 하는 최근에 기술된 현상은 숙주 면역계를 자극하는 세포 사멸의 한 형태입니다.
면역 기능을 억제하지 않고 암세포의 ICD를 유도하는 약제가 ICI 요법과의 조합에 이상적입니다.
이버멕틴이 유방암 세포에서 ICD를 촉진한다는 것을 발견했습니다.
이버멕틴이 P2X4/P2X7 퓨린성 경로를 조절한다는 증거가 있었는데, 이는 이버멕틴이 항암 활성을 위해 종양의 본질적인 높은 세포외 ATP 수준을 추가로 활용할 수 있음을 시사합니다.
Ivermectin 치료는 생체 내에서 ICD의 마커를 보여주는 암세포와 함께 차가운 종양을 뜨거운 종양으로 바꾸는 강력한 T 세포 침투로 이어졌습니다.
TNBC 종양을 저온에서 고온으로 전환하는 능력은 이버멕틴이 ICI 요법(예: 항-PD-1 단일클론 항체)과 시너지 효과를 낼 수 있음을 시사했습니다.
이 연구에서 이버멕틴과 항PD1 항체 조합으로 치료한 동물의 40-60%가 종양을 완전히 근절했습니다.
그들은 암이 재도입된 후 다시 암과 싸울 수 있었습니다.
두 약물이 함께 작용하는 것이 마법입니다.
두 약물 모두 단독으로는 거의 효과가 없지만 함께 사용하면 강력한 시너지 효과가 있습니다.
그런 다음 우리 팀은 임상적으로 관련된 다양한 설정에서 조합을 테스트했습니다.
우리는 치료 조합이 신보조 모델(수술 전)과 보조 모델(수술 후)에서도 효과가 있음을 발견했습니다.
가장 중요한 것은 이 조합이 전이성 유방암에 효과가 있었고 잠재적으로 동물의 50%를 치료했다는 것입니다.
암에서 새로운 이중 작용 메커니즘(항암 및 면역 조절)을 기반으로 하는 이버멕틴은 다른 FDA 승인 ICI의 항종양 활성을 강화할 수도 있습니다.
이러한 전임상 결과는 이버멕틴과 항-PD1 항체의 조합이 유방암 환자에서 임상 시험에 가치가 있음을 시사합니다.
참고한 글은
연구 결과는 npj 유방암 저널(2021)에 게재되었습니다.
Ivermectin은 차가운 종양을 뜨겁게 전환하고 유방암 치료를 위한 면역 체크포인트 차단과 시너지 효과를 나타냅니다.
https://doi.org/10.1038/s41523-021-00229-5
논문의 주요 내용을 요약해보면
우리의 결과는 이버멕틴을 사용한 치료가 ICD의 유도를 통해 유방 종양으로의 강력한 T 세포 침윤을 유도하여 "차가운" 종양을 "뜨거운" 것으로 바꾸는 것을 보여줍니다.
기존의 화학 요법 약물과 달리 이 약제는 숙주 면역 기능을 억제하지 않는다는 추가 이점이 있지만 오히려 유익한 면역 조절 효과가 있어 면역 관문 차단에 대한 유망하고 기계적 파트너가 됩니다.
종양 미세 환경으로 T 세포 침투를 유도할때 이버멕틴과 항-PD-1 체크포인트 차단 사이의 상승적 활성은 PD-1이 TCR 신호전달의 음성 피드백 조절자로서 기능하기 때문에 특히 흥미롭습니다.
P2X4/P2X7-gated Pannexin-1(PANX1) 개방 및 ATP 방출은 면역학적 시냅스에서 TCR 개시 및 ATP 구동 ATP 방출을 위한 피드포워드 루프를 제공함으로써 T 세포 활성화에서 중심 역할을 합니다.
따라서 암과 면역 세포 모두에서 작동하는 퓨린성 신호전달을 조절하는 P2X4/P2X7/PANX1 수용체의 알로스테릭 조절제로서의 이버멕틴의 능력은 종양 미세환경 및 면역학적 맥락 내에서 ATP 수준 상승에 의해 향상될 수 있습니다.
케모카인/TCR 신호 및 케모카인/TCR에 의한 ATP 방출의 크기를 포함합니다.
후자의 가능성과 일치하게, 우리는 Teff/Treg 비율에 대한 이버멕틴의 강화 효과가 PHA를 통한 T 세포 자극의 존재하에 더 강하고 지속되는 것으로 보인다는 것을 입증했습니다.
면역원성 암세포 사멸을 유도하고, 면역 세포를 차등적으로 조절하며, ATP가 풍부한 종양 미세 환경을 활용하는 이버멕틴의 다면적 효과가 생체내 면역 체크포인트 차단과 시너지 효과를 내는 능력에 모두 기여할 수 있는 방법을 밝히기 위해서는 추가 연구가 필요할 것입니다.
면역관문억제제(ICIs)는 암 환자의 작은 부분집합에서만 단일 약제로 효과적입니다.
수백 건의 임상 시험이 현재 FDA 승인 또는 실험 제제와 ICI의 다양한 조합을 테스트하고 있습니다.
PD-1 차단과 이버멕틴 사이의 시너지 효과는 면역원성 암세포 사멸과 T 세포 침윤을 종양으로 유도하여 "차가운" 종양을 "뜨거운" 종양으로 전환시키는 이버멕틴의 능력과 기계적으로 연관되어 있습니다.
대조적으로, 유사한 4T1 모델에서 ICD(예: 독소루비신)를 유도하는 것으로 알려진 확립된 1차 치료 표준 화학요법제와 결합된 PD-1 차단의 치료 가능성 평가는 지속적인 반응 또는 완전한 종양 퇴행을 달성하는데 실패했습니다 37 , 38.
독소루비신 단독은 종양으로의 유의한 T 세포 침윤을 유도하지 않았고 PD-1 차단과의 상승적 활성을 나타내지 않았다.
독소루비신이 종양을 "고열"로 바꾸거나 PD-1 차단과 효과적으로 시너지 효과를 내지 못하는 것은 직접적인 면역 효과를 반영하는 것 같습니다.
환자에서 달성된 혈장 수준에 해당하는 농도의 독소루비신은 말초혈액 단핵구(PBMC)에 상당한 세포독성을 일으키는 반면 생리학적으로 관련된 수준의 이버멕틴은 유의한 효과를 나타내지 않았습니다.
우리의 현재 연구에서 입증된 바와 같이, 이버멕틴과 PD-1 체크포인트 차단의 조합은 동물의 상당 부분에서 원발성 종양의 완전한 퇴행을 이끌었고 반응자에서 보호적인 항종양 면역성을 나타냈습니다.
우리는 계속해서 이 새로운 조합이 사용될 수 있는 임상 상황을 모방하는 신보강제, 보조제 및 전이 환경에서 효과적임을 입증했습니다.
암에 대한 새로운 이중 작용 메커니즘을 기반으로 하는 이버멕틴은 FDA 승인을 받은 다른 ICI의 항종양 활성을 강화할 수도 있습니다.
우리가 제시하는 전임상 결과는 이버멕틴과 항-PD1 항체의 조합이 유방암 환자에서 임상 시험을 할 가치가 있음을 시사합니다.
마우스 실험 내용을 소개하면
사용한 암세포는 4T1 cell.
=삼중음성 유방암과 유사하며 폐, 간 림프절, 뇌 및 뼈로 전이 가능하기에 유방암 전이 연구에 쓰임.
포함된 치료
=6일 동안 매일 경구 위관 영양법을 통해 제공되는 5 mg/kg의 이버멕틴(Sigma Aldrich, St. Louis MO)
=10 mg/kg의 항-PD1(BioXCell, West Lebanon NH) 치료는 매주 한 번 피하로 제공됨
=MSA-IL2는 매주 1회 멸균 PBS 50μL에 복강내 주사하여 1.5mg/kg으로 투여했다.
이버멕틴 및 항-PD1 항체 단독 또는 조합의 효능
시간 경과에 따른 평균 종양 부피는 무처리에 비해 이버멕틴 및 항-PD1 항체 조합에 의해 유의하게 감소하였다.
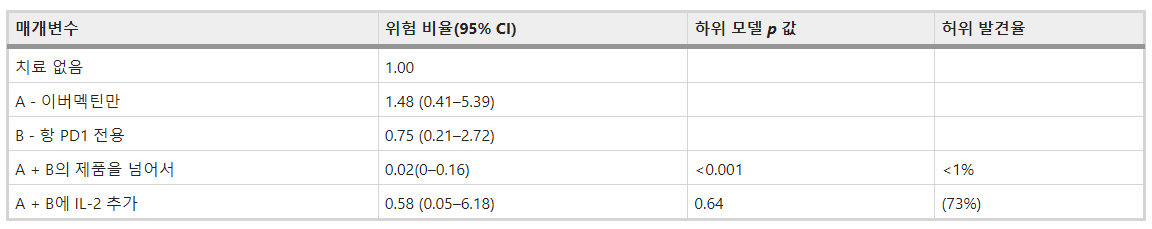
종적 종양 부피의 공동 통계 모델을 통해 이버멕틴과 항-PD1 항체는 약물의 개별 효과의 합(하위 모델 p = 0.008, 허위 발견률/FDR 3%) 의 합보다 훨씬 더 큰 효과로 정의되는 시너지 활성을 입증했습니다. ( 표 1).
완전한 종양 퇴행은 조합 치료에서 6/15 마우스, 이버멕틴 단독에서 1/20, 항-PD1 항체 단독에서 1/10, 무치료에서 0/25에서 관찰되었습니다.
이버멕틴과 항-PD1 병용 요법으로 종양을 해결한 마우스는 반대쪽 유방 지방 패드에 있는 100,000개의 4T1 세포로 재챌린지되었습니다.
이들 마우스 모두는 새로운 종양의 발생에 저항한 반면 대조군이 없는 동물은 모두 종양이 발생하였다.
이것은 이버멕틴과 항-PD1과의 병용 치료가 완전 반응자에서 보호 항종양 면역을 유도함을 시사합니다.
인터루킨-2(IL-2)를 사용한 이 조합 면역 요법을 더욱 강화하는 효과를 조사
IL-2는 T 세포 활성화를 유도하기 위해 암 치료에 성공적으로 사용된 최초의 사이토카인입니다 23.
IL-2를 치료적 항종양제로 개발하는데 있어 주요 도전과제는 IL-2가 T 세포와 조절 T 세포(Treg) 모두에 작용할 수 있다는 것입니다.
IL-2의 대조적인 작용은 일관되지 않은 반응을 일으키고 암 면역 요법을 위한 고용량 IL-2의 개발을 제한했습니다.
IL-2의 반감기를 증가시키는 것은 IL-2 기반 면역 요법을 개선하기 위한 유망한 전략인 것으로 나타났습니다.
이것은 치료 활동에 필요한 IL-2의 용량을 크게 줄여 안전성과 효능을 모두 향상시킬 수 있습니다 24 , 25 .
우리는 반감기가 연장된 재조합 알부민-IL-2 융합체를 이버멕틴 및 항-PD1 요법에 추가하면 우리의 결합 치료의 효능을 향상시킵니다.
(항-PD-1 + IL-2 요법, 단순성을 위해 "IP"라고 함)
IP 요법만을 사용한 치료는 치명적인 질병이 없는 동물의 ~40%로 약간의 생존 이점을 제공했습니다.
( p < 0.001, 그림 4E )
최고의 생존 결과는 IP와 이버멕틴 요법의 조합으로 나타났으며, 외과적 절제 후 동물의 ~75%가 장기 생존자가 되었습니다( p < 0.05, 그림 4A ).
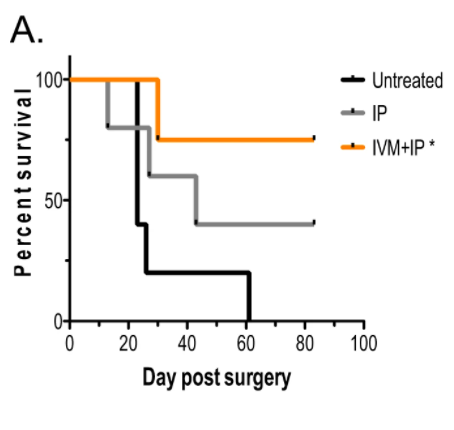
생존한 처리된 마우스는 반대쪽 유방 지방 패드에 100,000개의 4T1 세포로 다시 공격했습니다.
IVM + IP 처리된 마우스의 대부분은 새로운 종양이 발생하지 않았으며, 이는 장기간 지속되는 종양 특이적 면역의 발달을 나타냅니다.
IP 처리 및 대조군은 순진한 모든 종양이 발달했습니다.
이러한 결과는 이버멕틴 + IP 조합 치료가 신보조제 환경에서 효과적이며 반응자에서 잠재적으로 더 강력한 보호 항종양 면역을 유도함을 시사합니다.

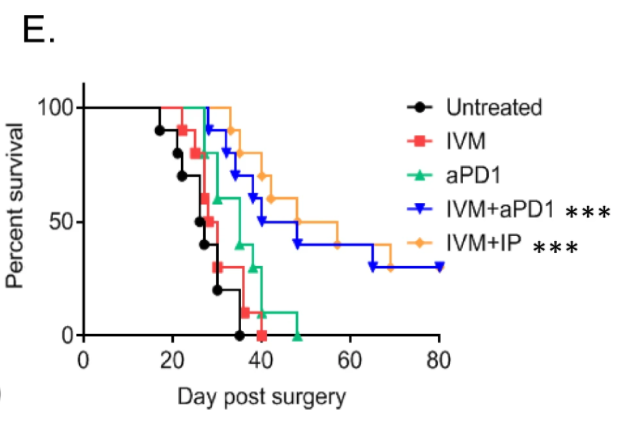
G Kaplan-Meier 생존 분석은 ivermectin, anti-PD1, ivermectin + anti-PD1 ± IL-2(IP) 또는 대조군으로 치료한 전이 환경에서 생쥐의 생존 분석입니다.
n = 그룹당 5마리 마우스, 양측 로그 순위 테스트; * p ≤ 0.05, ** p ≤ 0.01, *** p ≤ 0.001.
수술 후 면역 보조 요법으로서 이버멕틴, 항-PD1 및 재조합 IL-2 단독 또는 조합의 효능을 평가
보조 요법을 모방하기 위해 수술 후 2일째에 치료를 개시.
항-PD1 또는 IVM 단독 처리는 처리되지 않은 대조군과 유사한 생존을 나타냈다(도 4E ).
이버멕틴과 항-PD1(IL-2 유무에 관계없이)의 조합으로 처리된 동물은 생존 기간이 상당히 연장되었으며, 동물의 ~40%가 장기 생존자가 되었습니다( p < 0.001, 그림 4E ).
통계적 모델링을 통해 이버멕틴과 항-PD1 조합은 이버멕틴 또는 항-PD-1 단독에 비해 매우 상승적인 것으로 밝혀졌습니다(하위 모델 p = 0.007, FDR 2%, 표 2).
흥미롭게도, IL-2의 추가는 이버멕틴과 항-PD1 조합의 생존 이점을 추가로 향상시키지 않았습니다(하위 모델 p = 0.51, FDR 67%, 표 2 ).
이러한 데이터는 평행 체중 관찰에 기초한 약물 관련 또는 상승적 독성에 대한 증거없이 이버멕틴 및 항-PD1(IL-2 유무에 관계없이)을 사용한 치료가 보조제 설정에서 효과적임을 입증합니다(그림 S1B ).
표 2. 보조제 환경에서 무재발 생존.

전이성 환경에서 생존에 대한 이버멕틴의 효과
전이 환경에서 생존에 대한 이버멕틴 및 항-PD-1의 결합 효과는 이버멕틴 또는 항-PD-1 단독에 비해 매우 상승적인 것으로 다시 확인되었습니다. (하위 모델 p < 0.001, FDR < 1%)
보조제 설정에서와 같이 IL-2의 추가는 이버멕틴과 항-PD1 조합의 생존 이점을 추가로 향상시키지 않았습니다.
이러한 데이터는 이버멕틴 및 항-PD1(IL-2 유무에 관계없이) 치료가 전이 환경에서도 효과적임을 보여줍니다.
표 3. 전이성 환경에서 무재발 생존.
cd4 cell
=T 헬퍼세포, 단핵구, 대식세포 및 수지상세포와 같은 면역세포의 표면에서 발견된다.
=감염과의 싸움을 이끈다.
=cd4 + T helper cell은 인간 면역계의 필수적인 부분인 백혈구를 말한다.
cd8 cell
=세포독성 T 세포,
=암세포와 다른 침입자를 죽일수 있다.
=사이토카인을 분비하여 병원체에 대한 반응을 일으킬 수 있고 형질전환된 세포를 직접 사멸시켜 종양을 방어.
'암 치료 약물 > 이버멕틴' 카테고리의 다른 글
| 이버멕틴이 알콜중독 치료에 이용될 수 있다 (0) | 2022.04.28 |
|---|---|
| Ivermectin, 대장암 세포 성장 억제에 새로운 응용 (0) | 2022.01.14 |
| Ivermectin의 암에 대한 약속 (0) | 2021.10.22 |
| 심각한 이버멕틴 독성 및 인간 ABCB1 넌센스 돌연변이 (0) | 2021.09.15 |
| 위암 치료에서 이버멕틴 (0) | 2021.09.10 |