난소암의 증상 및 원인
www.mayoclinic.org/diseases-conditions/ovarian-cancer/symptoms-causes/syc-20375941
메이요클리닉의 자료입니다. 전반적인 내용은 참고하시고 중요한 사항만 요약하면...
-난소암의 90%가 상피종양. Wnt 신호 활성화 됨. 7%가 난소 조직에서 시작되는 기질종양.
-난자를 생산하는 세포에서 시작되는 생식세포종양은 휘귀하며 젊은 여성에게서 발생.
-위험 유전자는 유방암 유전자 1,2 =BRCA1,2. 유방암 위험도 증가시킴
항암표적
니클로사미드 = Wnt / β-catenin , 미토콘드리아 호흡
피르비늄 = Wnt경로
이버멕틴 = 키나아제 PAK1을 비활성화하고 PAK1 의존적 성장을 차단(in vitro)
니타조사나이드 = PDI억제제 역할,
-난소암에서 위타놀라이드와 이버멕틴은 강력한 WNT-TCF 차단제
-커큐민은 Wnt/β-catenin 및 Hippo/YAP 신호전달 경로에 대한 효과(여러 암에서 줄기 또는 증식을 억제)
-아스피린은 PGE2 발현을 억제하여 흑색종, 전립선암, 난소암 및 기타 암을 죽이는 것으로 입증됨
스타틴
-메발로네이트 경로에 위치한 HMG-CoA 환원효소를 차단하여 시험관 내에서 난소암 세포 증식을 억제하고 종양형셩을 지연시키고 생체내에서 종양진행을 억제하는 항 종양효과를 나타낸다
-스타틴은 시험관 내에서 세포 이동을 감소시켜 난소암 전이를 억제한다
비스포스포네이트
-골다공증약,
-시험관내에서 농도의존적으로 난소암 세포주의 증식을 억제
-형질전환 난소암 마우스모델에서 종양 형성이 현저히 지연되고 종양세포 증식 활성이 현저히 감소함
메트포르민
-난소암 진단시 메트포르민을 복용하고 있던 제2형 당뇨병 환자 16명, 다른 치료제를 복용중인 제2형 당뇨병 환자 28명, 당뇨병이 없는 암 환자 297명의 예후를 비교했는데 그 결과 5년 무진행 생존율은 다른 당뇨병 치료제 (8%) 또는 당뇨병이 없는 환자 (23%)보다 메트포민을 복용한 환자 (51%)에서 유의하게 더 좋았다.
비스테로이드성 항염증제(NSAID)
-용량에 따라 난소암에 효과적 일 수 있으며 난소암의 많은 경우를 설명하는 장액성 암종에 유용 할 수 있다
이버멕틴
-KPNB1 의존성 항종양 특성을 나타내는 것으로 입증됨.
-KPNB1 을 차단하면 세포자멸사를 유도하고 세포주기를 중단하는데 도움이 됨.
-이버멕틴을 파클리탁셀과 함께 생체내에서 사용하면 상승적인 항 종양 효과가 발생
이트라코나졸
-P-당단백질을 통한 화학 요법에 대한 내성을 변경하고, 자가포식을 유도하고, 고슴도치 신호 전달 경로를 조절하며, mTOR 및 Wnt/β 카테닌을 표적화하여 혈관화 및 림프관 생성을 차단하고 암-간질 세포를 방해
-백금제에 반응하지 않는 난소암 환자 19명에게 이트라코나졸을 투여했을 때 무진행 생존율(HR=0.24; p= 0.002)과 전체 생존율 (HR=0.27; p=0.006)이 보고되었음. 대조군에 비해 상당히 개선됨.
프로프라놀롤은 인간 난소 암 세포의 증식을 억제했습니다
-세포주기 관련 단백질을 조절함으로써 인간 난소암세포에서 G2/M phase 정지를 유발한다
프로프라놀올은 인간 난소암세포에서 외인성 미토콘드리아 경로를 모두 활성화 시켜 아포토시스를 유발한다
프로프라놀올은 인간 난소암세포에서 자가포식을 유발한다
자가포식억제제는 프로프라놀올-유도된 세포의 아포토시스를 촉진시켰다.
프로프라놀올에 의해 ROS 생성 및 JNK 활성화가 유발되었다
결과적으로 ROS/JNK 경로 활성화가 프로프라놀올-유도된 세포주기 정지, 아포토시스,오토파지에 참여했음을 밝혀냈다
2020년 연구, Niclosamide는 세포 생물 에너지를 방해하여 난소암종 성장을 억제합니다
Niclosamide 처리는 MEK1/ 2-ERK1/ 2 매개 신호전달을 비활성화하여 난소암종 성장을 유의하게 억제하고 세포 사멸을 유도했습니다.
전반적으로, 미토콘드리아 호흡과 호기성 해당 과정은 모두 니클로사미드 처리에 의해 감소되었습니다.
Niclosamide는 포도당 결핍을 겪은 세포에서 ROS 활성화 및 JNK 매개 세포사멸을 극적으로 향상 시켰습니다. Niclosamide는 또한 누드마우스 이식 종양모델에서 생체내 항 종양활성을 나타냈다.
난소암(EOC)은 PDI를 과발현한다. PDI는 단백질 폴딩에 영향을 미친다. 즉 UPR반응을 초래하고 결과적으로 세포사멸을 일으킨다. 여기서 PDI억제제 역할을 하는 NTZ가 난소암에 대한 새로운 대안이 된다.
이버멕틴은 lncRNA-EIF4A3-mRNA 축을 조절함으로써 난소암을 억제할 수 있습니다
https://cafe.naver.com/friendsofhippocrates/
https://link.springer.com/article/1...
2020년 연구, 니클로사미드는 생체 내에서 난소 암종 세포 성장을 억제하는데 효과적이며 MEK1 / 2-ERK1 / 2 신호를 비활성화 한다. OXPHOS억제제로 미토콘드리아의 산화적 인산화를 억제, ATP 생산을 제한, 포도당 부족 하에서 세포 사멸을 촉진한다.
https://www.jcancer.org/v11p3454.htm
상피난소암에서 Wnt 신호 활성화되며 니크로사미드가 유효.
pubmed.ncbi.nlm.nih.gov/24125749/
-난소암에서 위타놀라이드와 이버멕틴은 강력한 WNT-TCF 차단제
-커큐민은 Wnt/β-catenin 및 Hippo/YAP 신호전달 경로에 대한 효과(여러 암에서 줄기 또는 증식을 억제)
-아스피린은 PGE2 발현을 억제하여 흑색종, 전립선암, 난소암 및 기타 암을 죽이는 것으로 입증됨
<검토 대상>
제 경험상 저는 다음과 같이 난소암 환자를 좋은 효능으로 치료했습니다 .
1. 탈리도마이드 200mg, 셀레 콕 시브 400mg / 일 및 메트로놈 젬시 타빈 1000mg / 주.
2. 탈리도마이드 200mg, 셀레 콕 시브 400mg, 발 프로 산 600mg / 일 및 메트로놈 젬시 타빈 1000mg / 주.
3. 탈리도마이드 200mg, 셀레 콕 시브 400mg, 솔라 페닙 200-400mg / 일 및 메트로놈 젬시 타빈 1000mg /
저는 2000 년대부터 난소암 환자를 많이 치료했습니다. 탈리도마이드, 셀레콕시브 및 세포독성제인 젬시타빈 또는 이리노테칸의 조합으로 전체 생존을 연장할 수 있습니다. 일본 후생 노동성에 임상 시험 (일본어 치켄)을 제출했습니다. 그러나 이 임상 시험은 정확한 설명없이 거부되었습니다. 더욱이 탈리도마이드, 셀레콕시브, 발프로산 또는 / 및 저용량 세포 독성 약물의 조합은 암에서 난치성 염증 질환에 이르는 유망한 양식이 될 수 있습니다. 일본의 복지 관료들은 약에 대한 지적 능력과 지식이 부족하다고 생각합니다. 저는이 논문을 세계의 연구자들이 저의 요법의 효과를 인정할 것으로 기대하고 그 결과 일본에서 임상 시험을 수행할 수 있기를 기대하며 썼습니다. 진행성 난소암이 있는 젊은 여성은 복부 팽만감, 체중 감소, 변비 및 심각한 암 악액질과 같은 다양한 증상을 나타내는 심각한 복수 정체 및 복막염 암종을 유발합니다.
유방처럼 암 , 난소 암은 상피 기원에서 파생됩니다. NF-κB는 종양 억제자 역할을 하고 세포 사멸을 유도하기 때문에 난소 암에서 2 상 조절자 역할을 하지만, 화학 저항성 난소 암 세포에서 재 프로그래밍되고 종양 유전자로 작용할 수 있습니다 . 난소 암 치료의 중요한 문제는 백금 기반 화학 요법에 대한 저항성이며, NF-κB는 이러한 저항성을 개발하는 핵심 조절자 역할을 하므로 공격적인 재발성 난소 암의 원인이 됩니다. NF-κB는 혈관 신생을 촉진하고 암에 관여하기 때문에
진행, 그것은 치료 목적의 주요 표적 역할을 합니다. 탈리도마이드, 셀레코시브, 젬시타빈, 시스플라틴, 독소루비신, 제니스테인, 보르테 조밉, 설파살라진 등과 같은 다양한 약리 물질은 단독으로 또는 방사선 요법 또는 기타 약리와 병용하여 미 임상 연구에 진입했으며 다양한 유형의 암을 치료할 수있는 유망한 결과를 보여줍니다 (Hada 및 Mizutari 2004; Heinemann et al. 2000; Jimeno et al. 2006; Lo et al. 2010; Loehrer et al. 2011; Pavese et al. 2010; Wang et al. 2012).
-일본도 마찬가지인듯 ㅠ. 다른 각종 암 치료와 관련된 내용도 있습니다. 이 분 자료도 검토해볼 가치가 있어 보입니다.
-특히 NF-κB에 대한 관심이 큰데, NF-κB는 염증, 면역, 세포 증식, 분화 및 생존과 관련된 광범위한 과정에 관련된 핵 전사인자입니다.
벤즈이미다졸
ABZ는 또한 백혈병 및 난소암 세포와 같은 다른 미세소관 약물에 내성이 있는 세포에서도 활성이었습니다.
항 종양 작용 기전은 미세 소관을 방해하는 능력에 의존하는 것으로 보입니다.
ABZ에 대한 항 종양 작용의 또 다른 메커니즘이 제안되었습니다. 그것은 복막 난소 종양을 가진 마우스에서 혈관 내피 성장 인자 (VEGF) 생성과 종양 혈관 신생을 억제했습니다.
현재 암에서 ABZ를 조사하기 위해 한 임상 시험이 모집 중입니다 (임상 시험 번호 NCT02366884).
www.spandidos-publications.com/10.3892/ijo.2020.4966
albendazole은 난소암 모델에서 paclitaxel과 시너지 효과가 없었다.
난소암의 치료 및 유지를위한 메벤다졸의 잠재력과 기전
-Mebendazole은 난소암 세포주 및 고급 장액성 난소 PDX 종양의 성장을 억제합니다.
-Mebendazole은 유지 요법의 동소 난소암 모델에서 종양 형성을 억제합니다.
-Mebendazole의 활성은 p21 상승 및 세뇨관 불안정화와 관련이 있으며 돌연변이 p53 재 활성화로 보완됩니다.
www.gynecologiconcology-online.net/article/S0090-8258(20)34018-X/abstract
2021.01.15. 추가
난소암 유발성 복막암이 알벤다졸의 약동학에 미치는 영향
ar.iiarjournals.org/content/30/2/423.full
난소암으로 인한 복막강의 혈관 신생은 복막 암종 증, 악성 복수 형성, 이환율 및 높은 사망률로 이어집니다.
최근 연구에 따르면 albendazole (ABZ)이 혈관 신생 및 악성 복수 형성의 강력한 억제제인 것으로 나타났습니다.
난소암은 광범위한 복강 내 암종 증과 다량의 악성 복수 형성이 특징입니다.
혈관 내피 성장 인자 (VEGF)는 혈관 투과성 향상을 통해 신생 혈관화 및 후속적인 복강 내 종양 성장을 촉진하고 복수 형성을 유도함으로써 난소암의 진행에 중요한 역할을 하는 것으로 생각됩니다.
전임상 및 임상 연구 모두 난소암의 병태 생리학에서 VEGF의 주요 관여를 뒷받침 합니다.
이를 바탕으로 난소암 치료에서 VEGF를 표적으로 하는 약제를 활용한 새로운 치료법이 연구되고 있다.
경구 투여와 비교하여 ABZ의 복강 내 투여는 ABZ의 더 느리고 지속적인 흡수로 이어진다는 것을 보여주었습니다 .
전임상 연구에서 ABZ는 VEGF를 억제하고 악성 복수 형성을 폐지하는 것으로 밝혀졌습니다.
난소암 및 악성 복수 형성 환자에서 복막강을 감싸는 미세 혈관의 단면적이 증가하고 잉여 체액을 생성하는 역할이 나타났습니다.
또한 손상된 복막은 사이토카인과 성장인자, 특히 혈관신생 및 혈관과 투과성을 촉진하는데 중심적인 역할을하는 VEGF의 풍부한 공급원입니다.
VEGF 및 기타 혈관신생 촉진 인자의 영향으로 혈관이 확장되고 구부러지고 새며 정상적인 혈관의 단단한 내피 접합부가 부족합니다 .
결과적으로 물과 거대 분자에 대한 투과성이 증가하고 조직으로의 용질 전달이 제어되지 않습니다.
복막 암종증이 있는 생쥐에서 더 높은 ABZSO 농도는 복막강의 광대한 혈관화와 VEGF의 영향으로 이러한 혈관이 투과성이 높아 두 구획 사이의 분자 교환을 허용한다는 사실에 의해 설명될 수 있습니다 .
결과적으로, 전신 순환계에 들어가는 ABZSO는 복강내 고투과성 혈관을 통해 복강으로 분비됩니다.
2021. 9. 10. 추가
난소암(OC)
2020년 10월 21 PMCID : PMC7656306 PMID: 33092251
가장 널리 퍼진 아형은 고등급 장액 암종(HGSC) : 종종 진행된 병기, 특히 치명적.
치료 옵션은 제한적, 일반적으로 세포 축소 수술과 백금 기반 화학 요법.
많은 환자가 초기에 잘 반응, 하지만 약 75%가 불치의 재발을 일으킴.
OC의 주요 과제는 내화학성을 극복하기 위한 치료 전략.
OC 환경에서 많은 비종양 약물은 시험관 내 결과가 유망하며 그 중 일부는 이미 임상 시험에서 테스트되고 있습니다.
이러한 치료 화합물에는 항진균제(이트라코나졸), 항지질제(스타틴), 항당뇨병제(메트포르민), 항바이러스제(리토나비르), 항기생충제(이버멕틴) 및 골다공증 치료제(비스포스포네이트)가 포함됩니다.
그림 1.
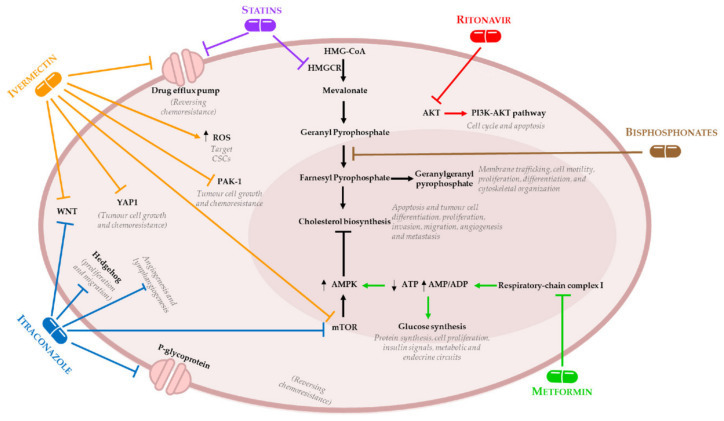
난소암(OC)에서 비종양 약물의 작용 메커니즘.
스타틴은 3-하이드록시-3-메틸글루타릴-코엔자임 A 환원효소(HMGCR)를 억제하여 메발로네이트 의존성 메커니즘을 통해 콜레스테롤 생합성 경로를 차단합니다.
게다가, 스타틴은 메발로네이트와 무관한 메커니즘에 의해 약물 유출 펌프를 차단할 수 있습니다.
비스포스포네이트는 HMGCR 하류에 위치한 파네실 피로포스페이트 신타제를 차단하여 콜레스테롤 생합성을 손상시킵니다.
메트포르민은 호흡 사슬 복합체 I 차단을 통해 인슐린 신호와 포도당 합성을 억제합니다.
리토나비르는 포스파티딜이노시톨 3-키나제(PI3K)-Akt 경로의 손상을 유발하는 인산화된 단백질 키나제 B(AKT)의 생성을 억제하는 프로테아제 억제제입니다.
이트라코나졸은 포유동물의 라파마이신 표적인 Hedgehog(mTOR) 및 Wnt 신호 전달 경로를 억제할 수 있습니다.
게다가, itraconazole은 혈관 신생 및 림프관 신생을 억제하고 P-당단백질의 과발현을 촉진할 수 있습니다.
이버멕틴은 MDR(multidrug resistance protein) 억제, Akt/mTOR 및 Wnt 신호 전달 경로 조절, p21-activated kinase(PAK-1) 및 yes-associated protein 1(YAP1)을 포함한 여러 세포 메커니즘을 방해합니다.
더욱이, 이버멕틴은 줄기세포 유전자의 하향조절로 이어지는 세포내 활성산소종(ROS) 수준의 증가를 촉진합니다.
'암 종류별 총정리 > 부인과 암' 카테고리의 다른 글
| 부인과 악성 종양 (자궁경부암, 자궁암, 질암, 외음부암) (0) | 2022.04.15 |
|---|---|
| 난소 암의 STAT3 신호 : 잠재적인 치료 표적 (0) | 2021.05.15 |